RESUMO
OBJETIVO: Avaliar a utilizaçao da pele de tilápia do Nilo como curativo oclusivo temporário nas queimaduras de segundo grau superficial e profunda em ratos.
MÉTODO: Estudo prospectivo, qualiquantitativo, no qual foram utilizados 40 ratos machos Wistar submetidos à cirurgia para produçao de queimadura, divididos aleatoriamente em quatro grupos: C1, no qual as feridas foram lavadas com soluçao salina; C2, no qual o curativo aberto foi tratado com sulfadiazina de prata a 1%; T1, queimadura de 2º grau superficial, tratado com curativo oclusivo utilizando a pele de tilápia; e T2, queimadura de 2º grau profundo, igualmente tratado com pele de tilápia. Os animais foram tratados e acompanhados por 22 dias. No último dia, os animais foram anestesiados para realizaçao de biópsia, coleta de sangue e foram eutanasiados.
RESULTADOS: No dia 21, os grupos T1 e T2 demonstravam melhor delineamento dos bordos da ferida. O exame microscópico revelou que amostras dos grupos T1 e T2 eram representadas por tecido conjuntivo fibroso destituído de revestimento epitelial, exibindo infiltrado inflamatório histiolinfoplasmocitário, com graus variados de intensidade, e permeado por ocasionais granulócitos polimorfonucleares neutrófilos restritos à regiao superficial. Nos grupos C2, T1 e T2 observava-se que o tecido conjuntivo profundo apresentava-se livre de inflamaçao. Os exames de sangue nao apresentaram alteraçoes significativas (p<0,05).
CONCLUSAO: A pele da tilápia apresentou boa aderência no leito das feridas induzidas por queimaduras nos ratos, interferindo positivamente no processo cicatricial. Estes resultados possibilitam o prosseguimento das investigaçoes para pesquisas em seres humanos, para confirmaçao de sua segurança e eficácia como curativo biológico.
Palavras-chave:
Queimaduras. Materiais Biocompatíveis. Cicatrização. Tilápia. Ferimentos e Lesões.
ABSTRACT
OBJECTIVE: To evaluate the use of tilapia skin as a temporary occlusive dressing in superficial and deep second degree burns in rats.
METHODS: A prospective, qualitative and quantitative study, in which 40 Wistar rats randomly divided into four groups and underwent surgery for burn production: C1, the wounds were washed with saline solution; C2, open dressing treated with silver sulfadiazine 1%; T1, superficial 2nd degree burn treated with an occlusive dressing of tilapia skin; and T2, deep 2nd degree burn also treated with tilapia skin. The animals were treated for 22 consecutive days. Blood was collected for hematological and biochemical tests on the last day and the animals were euthanized for histological analysis of the wound.
RESULTS: On day 21, groups T1 and T2 showed improved delineation of the wound edges. Microscopic examination revealed that samples of groups T1 and T2 were represented by fibrous connective tissue devoid of epithelial lining, displaying lymphoplasmacytic inflammatory infiltrate, with varying degrees of intensity, and permeated by occasional polymorphonuclear granulocytes neutrophils restricted to the surface area. In groups C2, T1 and T2 the deep connective tissue had no inflammation. Blood tests presented no significant changes (p<0.05).
CONCLUSION: The tilapia skin showed good grip on the wounds caused by burns in the tested rats, interfering positively on the healing process and not causing significant changes in hematological and biochemical parameters. These results allow the continuation of the investigations to clinical trials to confirm the safety and efficacy of its use as a biological dressing.
Keywords:
Burns. Biocompatible Materials. Wound Healing. Tilapia. Wounds and Injuries.
INTRODUÇAOA queimadura é uma lesao dos tecidos orgânicos, em decorrência de um trauma de origem térmica, que varia desde uma pequena bolha até formas graves, capazes de desencadear respostas sistêmicas proporcionais à extensao e à profundidade. Podem levar à desfiguraçao, à incapacidade e até à morte
1.
Inúmeros estudos têm sido realizados procurando encontrar curativos que reduzam os efeitos da contaminaçao nas lesoes, favoreçam o processo cicatricial e ofereçam melhores resultados estéticos. As coberturas, materiais ou produtos utilizados para tratar ou ocluir a ferida, impregnados ou nao com agentes tópicos, podem ser primárias, quando colocadas diretamente sobre a lesao, ou secundárias, quando têm como funçao cobrir as coberturas primárias
2.
Nos curativos oclusivos podem ser utilizados substitutos temporários de pele, que sao materiais eficazes no tratamento de queimaduras superficiais recentes e também na cobertura da pele, enquanto aguarda-se o enxerto definitivo. Podem ser trocados a intervalos regulares ou mantidos até a cicatrizaçao ou enxerto, caso a aderência seja boa ou nao haja infecçao
2.
Os substitutos de pele têm sido considerados úteis no tratamento de queimaduras superficiais, pois reduzem a frequência de troca do curativo. Entretanto, esses materiais têm alto custo e nao sao eficazes para o tratamento de queimaduras profundas. Devido aos custos elevados dos curativos oclusivos sintéticos ou biossintéticos, tem-se buscado nos materiais biológicos alternativas para o tratamento local de feridas provocadas por queimaduras
3.
pele da tilápia do Nilo (
Oreochromis niloticus) surge como um possível subproduto, com aplicabilidade clínica de novos biomateriais utilizáveis para bioengenharia. Pertencente à família dos ciclídeos, é originária da bacia do Rio Nilo, no Leste da Africa, encontrando-se amplamente disseminada nas regioes tropicais e subtropicais. A pele deste peixe é um produto nobre e de alta qualidade, pois possui resistência peculiar como couro, entretanto, nao existem estudos que evidenciem sua resistência como pele nao submetida ao curtimento
4.
A literatura reporta poucos trabalhos em que a pele de tilápia foi submetida ao processo de curtimento para confecçao de luvas e de vestimentas. Testes mecânicos de tracionamento sao descritos, conferindo o aproveitamento deste material, apesar da sua delgada espessura para este fim; no entanto, ainda nao existem trabalhos publicados sobre a possibilidade de utilizaçao desta pele como biomaterial, para recobrimento de feridas na pele humana por queimadura
4.
A caracterizaçao da pele de tilápia do Nilo, a partir de suas propriedades histomorfológicas, tipificaçao do colágeno e características físicas (resistência à traçao) foi realizada por pesquisadores do Núcleo de Pesquisa e Desenvolvimento de Medicamentos da Universidade Federal do Ceará
5. Concluiu-se que as características microscópicas da pele da tilápia sao semelhantes à estrutura morfológica da pele humana, apresentando derme composta por feixes de colágeno compactados, longos e organizados, em disposiçao paralela/horizontal e transversal/vertical, predominantemente, do tipo I. A pele também demonstrou elevada resistência e extensao à traçao em quebra.
Estes resultados puderam sinalizar a possibilidade de aplicaçao da pele da tilápia do Nilo como curativo biológico temporário em queimaduras. A realizaçao de estudos pré-clínicos
in vitro e
in vivo deve fornecer informaçoes preliminares de segurança e eficácia para que, posteriormente, sejam realizados estudos em seres humanos que comprovem os benefícios de sua utilizaçao em pacientes com lesoes causadas por queimaduras.
Inserido neste contexto, o presente estudo teve como objetivo a avaliaçao da utilizaçao da pele de tilápia do Nilo como curativo oclusivo temporário nas queimaduras de segundo grau superficial e profunda em ratos. O método de processamento, de descontaminaçao e de esterilizaçao da pele da tilápia e sua aplicaçao em queimaduras e feridas foi registrado no INPI com o número BR1020150214359.
MÉTODOTipo de Estudo e Local da PesquisaTrata-se de um estudo prospectivo, qualiquantitativo, realizado em laboratório do Núcleo de Pesquisa e Desenvolvimento de Medicamentos (NPDM) da Universidade Federal do Ceará (UFC), Fortaleza, CE, Brasil, no período de julho de 2015 a janeiro de 2016.
Aspectos ÉticosTodas as normas da Nomenclatura Anatômica Veterinária (1983) e os princípios éticos de experimentaçao animal do
International Council for Laboratory Animal Science foram seguidos.
O estudo foi aprovado pelo Comitê de Ética para Uso de Animais (CEUA) da Universidade Federal do Ceará, sob o número de protocolo 48/2016.
Obtençao e Processamento das AmostrasAs peles para os curativos oclusivos foram obtidas de tilápias do Nilo (
Oreochromis niloticus), provenientes da piscicultura de Castanhao (Jaguaribara, CE), cultivadas em tanque rede, de juvenis até o peso de abate, entre 800 a 1000 g, recebendo raçao comercial variando de 28 a 38% de proteína bruta. Os peixes foram insensibilizados por choque térmico (caixas isotérmicas com gelo moído e água, proporçao 1:1) e, em seguida, realizada a sangria.
Após o abate, as peles foram removidas com uma turquesa ( ferramenta) e, posteriormente, retiradas as escamas, submetidas à lavagem em água corrente, para a remoçao de qualquer resquício de sangue e outras impurezas e colocadas em soro fisiológico ( soluçao de NaCl a 0,9%) estéril, previamente resfriado a 4ºC, para a limpeza final. Em seguida, foram retirados os excessos de músculo, que ainda permaneceram ligados à pele, e feito o recorte em pedaços de 10,0 cm x 5,0 cm, lavados com soro fisiológico e obedecendo as etapas de esterilizaçao, para transporte entre os municípios Jaguaribara e Fortaleza (Captaçao e Acondicionamento Inicial):
1ª Etapa - as peles foram colocadas em um recipiente estéril, contendo gluconato de clorexidina (soluçao com tensoativos) a 2%, onde permaneceram por 30 minutos.
2ª Etapa - após a operaçao anterior, as peles foram lavadas com soro fisiológico estéril e removidas para outro recipiente, contendo outra soluçao de gluconato de clorexidina a 2%, onde permaneceram por 30 minutos.
3ª Etapa - as peles foram enxaguadas em soro fisiológico estéril e colocadas em um recipiente, contendo soluçao 50% de glicerol, 50% de soro fisiológico e embaladas para o transporte (trecho Jaguaribara- Fortaleza), numa caixa isotérmica contendo gelo.
As etapas seguintes realizadas no NPDM da UFC, em ambiente estéril, com fluxo laminar horizontal.
4ª Etapa - antes de 24h, as peles foram removidas da soluçao anterior, lavadas com soro fisiológico estéril e colocadas em um recipiente estéril e hermético, contendo 75% de glicerol, 25% de soro fisiológico (massagear as peles por 5 minutos nesta soluçao) e mantidas por 3 horas, num banho-maria, com agitador em velocidade constante de 15 rotaçoes por minuto e temperatura de 37ºC.
5ª Etapa - as peles foram removidas, lavadas com soro fisiológico estéril novamente e colocadas em outro recipiente estéril e hermético contendo 100% de glicerol (massagear as peles por 5 minutos nesta soluçao) e mantidas em banho-maria, na temperatura de 37ºC e 15 rotaçoes por minuto, por mais 3 horas.
6ª Etapa - ao final da última etapa do glicerol, as peles foram recondicionadas em duplos envelopes plásticos estéreis, com dupla selagem e armazenadas a 4ºC. Após esta etapa, as peles foram enviadas para radioesterilizaçao complementar, no Instituto de Pesquisa Energética Nuclear (IPEN-SP), em gama cobalto a 30 KGs. Quando as peles fossem ser usadas, eram removidas do envelope e lavadas por três vezes, em soluçoes diferentes de soro fisiológico estéril, por cinco minutos cada. Após este procedimento, as peles eram recortadas do tamanho da ferida e aplicadas como curativo oclusivo.
Foram realizados sete testes microbiológicos, para bactérias gram +, gram - e fungos, iniciando-se na pele
in natura (antes da primeira etapa) e nas seis etapas descritas acima.
Grupos de TratamentoForam utilizados 40 ratos machos adultos jovens, da linhagem Wistar (
Rattus norvegicus), procedentes do Biotério do NPDM, com peso corporal médio de 200 g, os quais foram previamente observados quanto às condiçoes gerais de saúde, recebendo raçao padrao para ratos e água ad
libitum.
Os animais foram igualmente divididos, aleatória e probabilisticamente, em quatro grupos compostos por 10 animais cada, de acordo com o esquema terapêutico previamente determinado:
Grupo C1 (controle 1; n=10) - as feridas foram lavadas com soluçao de NaCl a 0,9%; Grupo C2 (controle 2; n=10) - foi feito curativo aberto com sulfadiazina de prata a 1%; Grupo T1 ( tratamento 1; n=10; queimadura 2° grau superficial) - foi realizado curativo oclusivo com pele de tilápia, sendo suturado com fio de nylon 5-0; Grupo T2 (tratamento 2; n=10; queimadura 2° grau profundo) - utilizou-se curativo oclusivo com pele de tilápia, com sutura de fio de nylon 5-0.
Procedimento Cirúrgico para Produçao das FeridasOs ratos foram retirados das gaiolas, um por vez e pesados para calcular a dose anestésica. Em seguida, após a anestesia com administraçao intraperitoneal de cetamina (90 mg/kg) e xilazina (10 mg/kg), os animais foram imobilizados em decúbito ventral, realizando-se a tricotomia digital dos pelos do dorso, em uma área de aproximadamente 16,0 cm2 (4,0 cm x 4,0 cm). Em seguida, foi utilizado um gabarito de acetato de celulose, para demarcar na regiao dorsal (com caneta permanente) um quadrado de 3,0 x 3,0 cm. Posteriormente, procedeu-se à queimadura de 2º grau superficial e profunda, com chapa de alumínio de 9,0 cm2 (3,0 cm x 3,0 cm), aquecida a 100°C, pressionada na pele do dorso por 6 e 9 segundos, a depender do grupo. Após a cirurgia, os animais foram identificados de 1 a 10 dentro de seus respectivos grupos e mantidos em gaiolas individuais sem serragem, a uma temperatura média de 24°C.
O padrao de feridas nos grupos C1, C2, T1 (queimadura a 100ºC por 6 segundos) resultou em queimadura de 2º grau superficial. No grupo T2 (queimadura a 100ºC por 9 segundos), o resultado foi uma queimadura de 2º grau profundo.
Tratamento das Feridas com Curativos Abertos (Grupos C1 e C2)A partir do primeiro dia de pós-operatório, as feridas foram limpas diariamente com soluçao salina isotônica de NaCl (grupos C1 e C2), seguida, apenas no grupo C2, da aplicaçao de uma camada do antimicrobiano tópico sulfadiazina de prata a 1%, suficiente para cobrir as feridas por completo.
Tratamento das Feridas com Curativos Oclusivos (Grupos T1 e T2)No pós-operatório, as feridas foram limpas com soluçao salina isotônica de NaCl, seguida nos grupos T1 e T2 da aplicaçao da pele de tilápia, fixada com fio de nylon, nas quatro extremidades, avaliadas a cada quatro dias, por um período de 22 dias. Caso a pele estivesse solta, era trocada por uma nova pele. Todos estes procedimentos foram realizados com os ratos em plano anestésico recomendado.
Avaliaçao MacroscópicaOs animais foram mantidos vivos e avaliados até o 22º dia. Foram realizadas avaliaçoes dos dias D0, D5, D9, D12, D16, D19 e D21. O grupo controle C1 nao possuía curativo, o que permitia a visualizaçao e avaliaçao diária do ferimento; o grupo C2 realizou trocas diárias de curativos de sulfadiazina de prata; os grupos T1 e T2, como possuíam a pele da tilápia recobrindo o ferimento, foram avaliados a cada quatro dias com a abertura do curativo, que foi renovado quando necessário.
Coleta de Sangue e Avaliaçao de Parâmetros Hematológicos e BioquímicosApós o tratamento, os animais foram anestesiados com uma associaçao de cloridrato de xilasina (10 mg/kg) e cloridrato de cetamina (90 mg/kg) por via intraperitoneal, para coleta de sangue via punçao da veia cava abdominal para avaliaçao dos parâmetros hematológicos e bioquímicos dos grupos.
Retirada das PeçasTodos os animais foram eutanasiados por overdose anestésica (30 mg/kg de xilasina + 270 mg/kg de cetamina). Em seguida, nos grupos com curativos abertos, retirou-se um retalho de pele e de tela subcutânea contendo a ferida cicatrizada, em condiçoes assépticas. Nos grupos do curativo oclusivo, fez-se a retirada da pele de tilápia e procedeu-se da mesma forma com a ferida.
Análise Histológica da Pele dos RatosAs peças foram identificadas e fixadas em formol a 10%. Após a inclusao em parafina, o material foi cortado a 5 µm e corado pela técnica de hematoxilina e eosina. As lâminas foram analisadas sob microscopia ótica considerando-se a presença ou nao de úlcera, disposiçao dos feixes das fibras colágenas, fenótipo e intensidade do infiltrado inflamatório e necrose.
Análise EstatísticaOs resultados das avaliçoes hematológicas e bioquímicas foram submetidos à análise de variância (ANOVA) e comparados pelo Teste de Tukey usando o programa GraphPad Prism
® (GraphPad Software, Inc., California, USA), sendo o valor de p<0,05 considerado significante.
RESULTADOSNa avaliaçao macroscópica nos quatro grupos em estudo, nos dias D0, D5, D9, D12, D16, D19 e D21, foram constatadas as seguintes diferenças:
Nos grupos T1 e T2 nao foram necessárias trocas diárias de curativos, como nos grupos C1 e C2, em que a pele da tilápia permaneceu aderida ao leito da ferida. Somente renovou-se a pele quando os ratos removiam o curativo e destruíam a pele, o que aconteceu em oito ocasioes, de um total de 120 avaliaçoes nos grupos T1 e T2 (Figura 1).
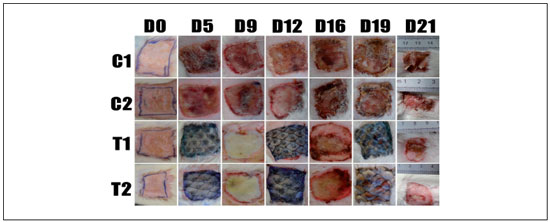 Figura 1
Figura 1 - Evoluçao cicatricial observada durante os 22 dias de acompanhamento dos ratos dos 4 grupos C1, C2, T1 e T2.
No grupo T1 e, especialmente, T2 observou-se presença de exsudato e crostas, especialmente após D12, conforme mostram as fotos destes grupos em D12, D16, D19 e D21 (Figura 1).
No D21 os grupos controles, C1 e C2, ainda apresentavam crostas e alguma presença de tecido de granulaçao.
Observou-se um melhor delineamento dos bordos da ferida no processo de cicatrizaçao, nos grupos em tratamento com a pele da tilápia.
Com relaçao aos parâmetros hematológicos e bioquímicos (Tabela 1), nao foram verificadas quaisquer alteraçoes significativas dos parâmetros bioquímicos dos animais tratados nos diferentes grupos (
p<0,05), exceto para a ureia, que se apresentou discretamente aumentada nos grupos T1 e T2 em relaçao aos grupos controles, porém sem significância. Além disso, foi observado que os valores de glicose estavam acima do valor estabelecido para essa espécie de animal em todos os grupos, fato justificado pelas doses anestésicas.
Na análise histológica, o grupo controle negativo (queimadura a 100ºC, 6 segundos, tratado com soluçao salina) apresentou derme constituída por tecido conjuntivo fibroso destituído de revestimento epitelial, recoberto por membrana fibrinogranulocítica, exibindo intenso infiltrado inflamatório neutrofílico na regiao mais superficial. Visualizaram-se, ainda, células inflamatórias linfoplasmocitárias em meio à proliferaçao de células fusiformes, além de hemácias extravasadas. Na profundidade, observou-se tecido muscular esquelético sem alteraçoes histológicas (Figura 2A).
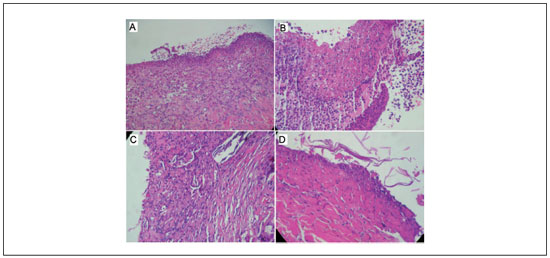 Figura 2
Figura 2 - A: Grupo C1 - úlcera e denso infiltrado inflamatório leucocitário misto; B: Grupo C2 - úlcera recoberta por membrana fibrinolítica e denso infiltrado inflamatório leucocitário misto; C: Grupo T1 - derme destituída de revestimento epitelial e com discreto infiltrado inflamatório mononuclear; D: Grupo T2 - derme sem epitélio de revestimento e com discreto infiltrado inflamatório mononuclear. HE; A - 100x; B - 200x; C - 200x; D - 200x.
Os animais do Grupo C2, com queimadura a 100ºC, por 6 segundos e tratados com sulfadiazina de prata a 1%, mostraram tecido conjuntivo fibroso destituído de revestimento epitelial exibindo, na superfície, membrana fibrinolítica associada a intenso infiltrado leucocitário misto, com granulócitos polimorfonucleares (neutrófilos) e hemácias extravasadas. Na profundidade, observavam-se feixes colagênicos espessos livres de inflamaçao (Figura 2B).
No grupo T1, com queimadura a 100ºC, por 6 segundos e tratados com curativo biológico de tilápia, observou-se, nas amostras, tecido conjuntivo fibroso sem revestimento epitelial com intenso infiltrado inflamatório histiolinfoplasmocitário em ninhos, os quais se estendiam por entre os feixes de colágeno. Em trechos, observavam-se granulócitos polimorfonucleares neutrófilos, predominantemente, na regiao superficial. Somente em duas amostras foi visualizado um infiltrado intensamente agudo (Figura 2C).
No Grupo T2, em que a queimadura foi igualmente a 100ºC, mas por 9 segundos, a análise microscópica revelou tecido conjuntivo fibroso sem epitélio de revestimento, com discreto a moderado infiltrado inflamatório mononuclear (histiolinfoplasmocitário), com ocasionais granulócitos polimorfonucleares neutrófilos restritos à regiao superficial. Na profundidade o córion fibroso estava livre de inflamaçao (Figura 2D).
DISCUSSAOAs feridas decorrentes de queimaduras caracterizam-se como uma soluçao de continuidade produzida em um tecido, dando lugar a um espaço anormal, à interrupçao do fluxo sanguíneo, à perturbaçao da sensibilidade, ao acúmulo de elementos celulares mortos e a um grau maior ou menor de contaminaçao, com ou sem infecçao. Uma vez estabelecido o dano tecidual, o organismo desencadeia uma complexa sequência de eventos, na tentativa de restaurar morfofisiologicamente o mesmo. Inicia-se um processo inflamatório agudo induzido pela própria lesao, seguido da regeneraçao das células parenquimatosas, migraçao, proliferaçao e remodelaçao de tecido conjuntivo, síntese proteica, colagenizaçao e aquisiçao de força tensil
6.
Inúmeros fatores, sistêmicos e locais, podem interferir no processo de reparaçao tecidual. Um bom fluxo sanguíneo é exigência para uma cicatrizaçao efetiva. Apesar do gradiente de hipóxia ser essencial para alguns eventos da cicatrizaçao, as fases inflamatória e de síntese do colágeno sao dependentes de uma perfusao adequada. Infecçoes causam atraso na regeneraçao tecidual
7.
Nas lesoes de 2º e de 3º graus, com grande superfície corporal atingida, o tratamento clínico inclui reposiçao hídrica adequada, através de uma veia de grande calibre, controle da diurese (através de sonda vesical), suporte enteral (através de sonda nasogástrica ou enteral), para evitar a hemorragia digestiva e a translocaçao bacteriana, boa analgesia horária e, em alguns casos, antibioticoterapia. O tratamento cirúrgico vai desde os curativos, passando pela escarotomia e pela fasciotomia, pelos desbridamentos, pelas amputaçoes, pelos enxertos, pelos retalhos fasciocutâneos, até os retalhos livres
7.
O tratamento das feridas causadas por queimaduras representa um desafio diário para a equipe de saúde multidisciplinar hospitalar. Estao disponíveis inúmeros tipos de curativos para o tratamento de queimaduras. Dentre eles, estao o alginato de prata, hidrogéis, curativos úmidos e a sulfadiazina de prata, creme amplamente utilizado atualmente nos serviços públicos de tratamento de queimados
1.
Em nosso país, na maioria dos centros de tratamento de queimados da rede pública, tem-se a seguinte conduta, em relaçao aos curativos: nas queimaduras de segundo grau é realizado diariamente o banho com clorexidina a 2% e o curativo é feito com o antimicrobiano tópico sulfadiazina de prata a 1%, até a completa reparaçao da lesao (2º grau superficial em torno de 12 dias e profundo entre 21 e 25 dias); nas lesoes de terceiro grau é realizado o desbridamento do tecido necrótico em várias etapas (desbridamento sequencial), feito o curativo com sulfadiazina de prata a 1%, até a preparaçao do leito da ferida para a enxertia.
Na rede privada, em nosso país, este cenário se modifica e, dependendo do tipo de convênio ou das condiçoes financeiras do paciente, sao usados curativos biossintéticos e peles artificiais, todos importados e de elevado custo. Na Europa e nos Estados Unidos da América, sao utilizadas, nestas lesoes de 2º e de 3º graus, peles homólogas (através dos inúmeros bancos de pele), peles heterólogas, curativos biossintéticos e derme artificial para melhorar a sobrevida e ter boa recuperaçao funcional. Infelizmente, em um país com as dimensoes do Brasil, há apenas em funcionamento três bancos de pele, sendo um em Sao Paulo (Hospital das Clínicas), um no Paraná (Hospital Evangélico) e o outro em Porto Alegre (Santa Casa de Misericórdia), uma vez que o único banco do Nordeste, localizado em Recife (IMIP), encontra-se desativado
1.
No entanto, publicaçoes mais recentes demonstram que curativos biológicos e sólidos têm eficácia superior, notadamente nos quesitos: menor tempo de fechamento de feridas, maior taxa de reepitelizaçao e reduçao de dor, e que nao existem dados suficientes que suportem o uso e a eficácia de sulfadiazina de prata 1%
8,9.
Tais informaçoes corroboram os resultados do presente trabalho, no qual nao foi possível observar benefícios de utilizaçao desta formulaçao na cicatrizaçao das feridas em relaçao ao grupo controle que utilizou apenas soluçao fisiológica 0,9%, estimulando um intenso infiltrado inflamatório leucocitário misto, com presença de granulócitos polimorfonucleares neutrófilos.
Na busca por novas alternativas terapêuticas para queimados, vêm se destacando os curativos biocompatíveis e/ou biológicos. Bolsa amniótica, pericárdio e pele de porco já estao sendo utilizados, apresentando adequada biocompatibilidade e eficácia
10. Neste contexto, surge a possibilidade de se aproveitar a pele da tilápia, que seria um produto de descarte, no intuito de ajudar este tratamento tao sintomático, podendo vir a ser uma opçao de biomaterial de custo acessível.
Na pesquisa realizada pela equipe de pesquisadores do NPDM, foi observado que a pele da tilápia, quando submetida aos processos de esterilizaçao química e de irradiaçao complementar, nao apresenta variaçoes quanto à sua estrutura microscópica e tensiométrica, recuperando sua consistência
in natura após o processo de reidrataçao
5. Também já foi reportado na literatura que a glicerolizaçao e a irradiaçao em curativos biológicos em doses moderadas possuem a capacidade de fixar os tecidos por meio de reduçao do fluido intersticial sem, no entanto, provocar degeneraçao
11.
Estudos histológicos da pele da tilápia demonstraram uma epiderme revestida por um epitélio pavimentoso estratificado, seguido de extensas camadas de colágeno
12. O colágeno configura-se como um dos principais componentes dos biomateriais, devido à sua característica de orientar e de definir a maioria dos tecidos, além de possibilitar biodegradabilidade e biocompatibilidade, que favorecem a sua aplicaçao
13. Desta forma, o detalhamento da quantidade e o tipo de colágeno presente constituem-se como uma das formas de caracterizaçao de biomateriais.
Tang & Saito
14 demonstraram que o colágeno tipo I da pele da tilápia estimula Fatores de Crescimento de Fibroblastos (FGF), os quais expressam e liberam Fator de Crescimento de Queratinócitos (KGF), duas citocinas importantes e imprescindíveis para o fechamento das feridas.
O padrao de cicatrizaçao observado nos grupos tratados com a pele da tilápia foi superior devido à sua capacidade de obstruir a ferida, minimizando exsudatos e a formaçao de crostas. No presente estudo, foram encontradas reaçoes inflamatórias de intensidade leve a moderada nas feridas recobertas pelas peles de tilápia, com fenótipo mononuclear (histiolinfoplasmocitário), diferentemente da intensa resposta aguda observada nos grupos controle, interferindo positivamente no processo de cicatrizaçao, confirmando o benefício de sua utilizaçao.
Notadamente, a inflamaçao crônica é caracterizada por uma resposta proliferativa, em que os macrófagos desempenham funçoes importantes no processo de cicatrizaçao associados com deposiçao de colágeno e neoformaçao vascular. Os macrófagos do tipo M2 expressam citocinas e fatores de crescimento importantes para a reparaçao tecidual.
Quanto aos parâmetros hematológicos e bioquímicos, os mesmos mantiveram-se dentro da normalidade para a espécie estudada, com exceçao da ureia, que se apresentou elevada nos grupos tratados, quando comparada aos resultados observados nos grupos controles. Variaçoes deste parâmetro também já foram descritas por outros autores
15.
Outra exceçao deve ser feita aos valores de glicose, que se apresentaram superiores aos valores de referência estabelecidos em todos os grupos estudados. Este achado pode ser explicado devido à açao hiperglicêmica do anestésico cloridrato de cetamina utilizado na induçao anestésica dos animais
16.
O curativo ideal é aquele de fácil obtençao, de baixo custo, de fácil armazenamento, de estabilidade prolongada, que nao apresenta antigenicidade, mas boa flexibilidade, resistência ao estiramento, aderência ao leito, boa adaptaçao ao contorno das feridas e facilitaçao dos movimentos articulares. Acrescenta-se, ainda, que o material deve ter aplicaçao em um único tempo cirúrgico, que seja de fácil manipulaçao, que suprima a dor, acompanhe o crescimento corporal e mantenha a temperatura do corpo.
Os curativos biológicos devem prevenir as perdas hidroeletrolíticas, evitando a contaminaçao bacteriana e promovendo a epitelizaçao nas queimaduras de segundo grau superficial e profundo e propiciando a formaçao de adequado tecido de granulaçao, para enxertia, nas lesoes de terceiro grau
1.
Estamos muito distantes de ter o substituto cutâneo temporário ideal. Alguns curativos heterólogos já foram testados e usados no Brasil, porém abandonados ao longo do tempo, seja pelo elevado custo de importaçao, como a pele porcina, ou pela falta de estudos científicos adequados, como a pele de ra ou pela transmissao de doenças animais, que todos podem causar, a nao ser quando a pele é irradiada, aumentando os custos. Tecidos biológicos de origem animal, como a pele de cao, a pele de porco, a pele de ra, o pericárdio bovino e a camada submucosa de intestino de porco, têm sido utilizados em curativos oclusivos biológicos (heteroenxertos), nas lesoes por queimaduras
17-20. Entretanto, para a liberaçao e a utilizaçao desses materiais, eles devem ser submetidos a rigorosos protocolos, para a identificaçao da sua real contribuiçao, segurança, eficácia e biocompatibilidade
1.
Os resultados obtidos no presente estudo possibilitam o prosseguimento das investigaçoes para Ensaios Clínicos Fase I em seres humanos saudáveis e, posteriormente, para estudos Fase II e III em pacientes com queimaduras, para confirmaçao da segurança e eficácia de sua utilizaçao, como uma alternativa de curativo biológico para tratamento destas feridas.
CONCLUSAOA pele da tilápia apresentou boa aderência no leito das feridas induzidas por queimaduras nos ratos testados, interferindo positivamente no processo cicatricial e nao causando alteraçoes relevantes nos parâmetros hematológicos e bioquímicos de funçao renal e hepática, sendo um potencial curativo biológico para o tratamento desta natureza.
AGRADECIMENTOOs autores gostariam de agradecer aos pesquisadores e pessoal de apoio técnico do Núcleo de Pesquisa e Desenvolvimento de Medicamentos da Universidade Federal do Ceará e ao IPEN-SP; à ENEL, empresa financiadora da pesquisa; ao Instituto de Apoio ao Queimado, ONG que gerencia e coordena a pesquisa.
REFERENCIAS1. Lima Júnior EM, Novaes FN, Piccolo NS, Serra MCVF. Tratado de Queimaduras no Paciente Agudo. 2a ed. Sao Paulo: Atheneu; 2008.
2. Gomes FSL, Borges EL. Coberturas. In: Borges EL, Saar SRC, Lima VLAN, Gomes FSL, Magalhaes MBB. Feridas: como tratar. Belo Horizonte: Coopmed; 2001. p. 97-120.
3. Hansbrough JF, Zapata-Sirvent RL, Cooper ML. Effects of topical antimicrobial agents on the human neutrophil respiratory burst. Arch Surg. 1991;126(5):603-8.
4. Franco MLRS, Franco NP, Gasparino E, Dorado DM, Prado M, Vesco APD. Comparaçao das peles de tilápia do Nilo, pacu e tambaqui: Histologia, composiçao e resistência. Arch Zootec. 2013;62(237):21-32.'
5. Alves APNN, Verde MEQL, Ferreira Júnior AEC, Silva PGB, Feitosa VP, Lima Júnior EM, et al. Avaliaçao microscópica, estudo histoquímico e análise de propriedades tensiométricas da pele de tilápia do Nilo. Rev Bras Queimaduras. 2015;14(3):203-210.
6. Bolgiani A, Lima Júnior EM, Serra MCVF. Quemaduras: condutas clínica e quirúrgicas. 2a ed. Sao Paulo: Atheneu; 2013.
7. Lima Júnior EM, Serra MCVF. Tratado de Queimaduras. Rio Janeiro: Atheneu. 2004.
8. Aziz Z, Abu SF, Chong NJ. A systematic review of silver-containing dressings and topical silver agents (used with dressings) for burn wounds. Burns. 2012;38(3):307-18.
9. Heyneman A, Hoeksema H, Vandekerckhove D, Pirayesh A, Monstrey S. The role of silver sulphadiazine in the conservative treatment of partial thickness burn wounds: A systematic review. Burns. 2016;42(7):1377-86.
10. Song G, Wu Y, Wang F, Shao Y, Jiang J, Fan C, et al. Development and preparation of a low-immunogenicity porcine dermal scaffold and its biocompatibility assessment. J Mater Sci Mater Med. 2015;26(4):170.
11. Zidan SM, Eleowa SA. Banking and use of glycerol preserved full-thickness skin allograft harvested from body contouring procedures. Burns. 2014;40(4):641-7.
12. Souza MLR, Santos HSL. Análise morfológica da pele da tilápia do Nilo (Oreochromis niloticus) através da microscopia de luz. Rev Unimar. 1997;19(3):881-8.
13. Cen L, Liu WEI, Cui LEI, Zhang W, Cao Y. Collagen tissue engineering: development of novel biomaterials and applications. Pediatr Res. 2008;63(5):492-6.
14. Tang J, Saito T. Biocompatibility of Novel Type I Collagen Purified from Tilapia Fish Scale: An In Vitro Comparative Study. Biomed Res Int. 2015;2015:139476.
15. Branco ACSC, Diniz MFFM, Almeida RN, Santos HB, Oliveira KM, Ramalho JA, et al. Parâmetros bioquímicos e hematológicos de ratos wistar e camundongos swiss do biotério professor Thomas George. Rev Bras Ciênc Saúde. 2011;15(2):209-14.
16. Braslasu MC, Braslasu ED, Bradatan C, Savulescu I, Gojmaleatana R, Budai M, et al. Experimental studies regarding the diabetes mellitus induced in white wistar rats. Lucrari Stiinlifice Med Vet. 2007;40:109-16.
17. Wai RT. Use of glycerol-preserved skin in plastic surgery. Burns. 1994;20 Suppl 1:S27-30.
18. Ramsey DT, Pope ER, Wagner-Mann C, Berg JN, Swaim SF. Effects of three occlusive dressing materials on healing of full-thickness skin wounds in dogs. Am J Vet Res. 1995;56(7):941-9.
19. Leto Barone AA, Mastroianni M, Farkash EA, Mallard C, Albritton A, Torabi R, et al. Genetically modified porcine split-thickness skin grafts as an alternative to allograft for provision of temporary wound coverage: preliminary characterization. Burns. 2015;41(3):565-74.
20. Zaidi AH, Nathan M, Emani S, Baird C, del Nido PJ, Gauvreau K, et al. Preliminary experience with porcine intestinal submucosa (CorMatrix) for valve reconstruction in congenital heart disease: histologic evaluation of explanted valves. J Thorac Cardiovasc Surg. 2014;148(5):2216-4.
Recebido em
6 de Maio de 2017.
Aceito em
1 de Junho de 2017.
Local de realização do trabalho: Universidade Federal do Ceará, Núcleo de Pesquisa e Desenvolvimento de Medicamentos (NPDM), Fortaleza, CE, Brasil.
Fonte de financiamento: A pesquisa foi financiada pela ENEL através de um convênio com o Instituto de Apoio ao Queimado.
Conflito de interesses: Os autores declaram não haver.