RESUMO
Foi realizada extensa revisao acerca do tema necrólise epidérmica tóxica e síndrome de Stevens Johnson, reunindo-se notável gama de informaçoes no que se refere a manifestaçoes clínicas, diagnóstico e técnicas recentes de tratamento. Ao final desta pesquisa de aprofundamento clínico e aprendizado, os autores visam o oferecimento de conhecimento sobre essas raras e graves manifestaçoes comuns em centros de terapia de grandes queimados, destacando o papel desses locais na avaliaçao médica multidisciplinar de tais pacientes, assim como tratamento e suporte rápido à vida.
Palavras-chave:
Unidades de queimados. Necrólise epidérmica tóxica. Toxicidade de drogas.
ABSTRACT
Review article of toxic epidermal necrolysis and Stevens-Johnson syndrome flocking remarkable range of information regarding the clinical, diagnosis and recent treatment techniques. The author's aim, at the end of this further research and clinical learning, offer knowledge about these rare and severe manifestations common in centers of large burns therapy, highlighting the role of local multidisciplinary medical evaluation of such patients, as well as treatment and support.
Keywords:
Burn units. Epidermal necrolysis, toxic. Drug toxicity.
Constituem a Síndrome de Stevens-Johnson (SSJ) e a Necrólise Epidérmica Tóxica (NET) um raro e potencialmente fatal agregado de manifestaçoes mucocutâneas, caracterizadas por necrose epidérmica generalizada e envolvimento de mucosas secundário à apoptose de queratinócitos. Dessa forma, segue-se a tal processo, o aspecto descamativo epidérmico extenso característico que, por sua vez, assemelha-se ao quadro clínico de um grande queimado1. Importante mencionar a variaçao da perda epidérmica, podendo esta ser mínima ou intensa, excedendo, assim, a capacidade das enfermarias de clínica médica e, por conseguinte, exigindo internaçao do paciente em uma unidade de terapia para grandes queimados, voltada ao suporte orgânico necessário vital2.
A incidência da NET é estimada em 0,4-1,2 casos/milhao de pessoas ao ano, enquanto a SSJ tem sido relatada em 1-7 casos/milhao de pessoas por ano3. Essas desordens esfoliativas ocorrem em todas as faixas etárias; no entanto, a incidência aumentou em idosos e mulheres3, sendo pelo menos 1000 vezes mais elevada em pacientes HIV positivos4. Os pacientes com lúpus eritematoso sistêmico também podem ter risco mais elevado, mas isto pode ser reflexo da elevada prescriçao de medicamentos nesses pacientes4.
Acredita-se que pelo menos 80% dos casos de NET sejam induzidos por drogas, enquanto a proporçao de casos SSJ causados por medicamentos é um pouco menor, com estimativas variando entre 50%-80%4. Dentre os fármacos, merecem maior evidência: sulfonamida, alopurinol, carbamazepina, fenitoína e fenobarbital5. Outras causas possíveis incluem o agente infeccioso
Mycoplasma pneumoniae como causa de SSJ
6 e administraçao de vacinas, como varíola, sarampo, tríplica viral e bacteriana, poliomielite e gripe5, além de produtos químicos ambientais, terapia de radiaçao e doença enxerto versus hospedeiro4.
ASSOCIAÇOES FARMACO-GENÉTICASEstudos demonstram correlaçoes genéticas com tais desordens mucocutâneas esfoliativas graves, reforçando a citada participaçao farmacológica no processo. Dessa forma, observa-se a associaçao de carbamazepina induzindo SSJ e NET, com o alelo HLA-B*1502 entre chineses representando a mais forte associaçao descrita até agora entre HLA-doença7, sendo, também, confirmada em outros grupos populacionais do Sudeste Asiático8-10. Nos Estados Unidos, o
Food and Drug Administration (FDA) tem recomendado um screening genético para todos os pacientes que necessitam de carbamazepina11. Há recomendaçao para se evitar o uso dessas drogas, pois elas também podem ser prejudiciais em diversos aspectos12. Muitas outras associaçoes genéticas entre as desordens apresentadas no presente artigo surgiram recentemente; HLA-A*3101 e HLA-B*1511 com carbamazepina, HLA-B*1502 com fenitoína9, HLA-B*5801 com Alopurinol8,13-15, HLA-B*38 com sulfametoxazol ou lamotrigina e HLA-B*73 com oxicam, anti-inflamatório nao esteroide14. Um conhecimento preciso e específico dos riscos associados com vários HLAs poderia, eventualmente, permitir a criaçao de um banco de dados genéticos, permitindo, assim, que prescriçoes fossem adaptadas para indivíduos dos grupos de risco genéticos.
CARACTERISTICAS CLINICAS/CLASSIFICAÇAOO envolvimento cutâneo é precedido por uma fase prodrômica que, com frequência, consiste em sintomas de gripe, incluindo febre alta, mal-estar, tosse, mialgia, artralgia e outros sintomas que podem sugerir infecçao do trato respiratório superior. Esses sintomas podem preceder qualquer manifestaçao cutânea por 1 a 21 dias, mas geralmente duram 2 a 3 dias16-18.
Esse quadro clínico é seguido pelo aparecimento de lesoes na pele, podendo evoluir a partir de erupçoes morbiliformes, eritematosas, lesoes em alvo atípicas ou máculas purpúricas19 para, mais tarde, vesículas e bolhas grandes nas áreas de eritema. Os pacientes podem apresentar eritema difuso seguido por epidermólise20 (Figuras 1 e 2). Vislumbra-se, ainda, a típica separaçao epidérmica induzida pela pressao lateral suave na superfície da pele, fenômeno este que recebe a denominaçao de sinal de Nikolsky. Em seguida, separaçao em folhas de epiderme da derme e, subsequentemente, uma exposiçao da derme, o que pode se tornar muito extenso. A perda epidérmica total no prazo de 24 horas nao é infrequente5. Os principais locais acometidos sao tronco e face, mas também pode ocorrer em extremidades proximais e pescoço5. Geralmente, um período de latência de 1 a 3 semanas é observado a partir da iniciaçao de um fármaco até a erupçao da pele21. Esse período pode ser mais curto em reexposiçao de um individual previamente sensibilizados16.
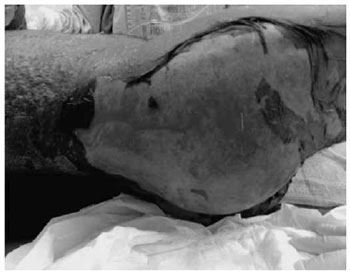
Figura 1 - Detalhe de lesao eritematosa com áreas de necrose denotando perda epidérmica grave, típica da necrólise epidérmica tóxica.
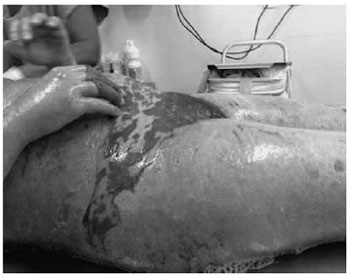
Figura 2 - Eritema difuso com área de necrose e separaçao quase que completa da epiderme.
O comprometimento de duas ou mais áreas de mucosas sao típicos da SSJ e NET, sendo que este pode preceder lesoes de pele por 1 a 3 dias em um terço dos casos22,23. Várias áreas de mucosas sao geralmente afetadas, e a sua ordem de frequência é: orofaringe, ocular, genital e anal5. A maioria dos pacientes com NET possui múltiplas lesoes em mucosas, que, geralmente, persistem por mais tempo do que as lesoes cutâneas20.
Na classificaçao dessas desordens esfoliativas graves da pele e mucosas, SSJ é considerado quando a área de superfície corporal total afetada for menor que 10%, enquanto que na NET a área afetada tem que ser superior a 30%3, existindo uma zona de sobreposiçao entre 10% a 30%, que é referido como transiçao SSJ/ NET16,21. Sendo assim, o prognóstico está diretamente relacionado com a área de descolamento da epiderme, o que reflete na baixa mortalidade da SSJ, em torno de 1% a 3%, enquanto NET possui 30%24,25. Importante salientar que a infecçao constitui a causa mais comum de morte nessas desordens esfoliativas26.
DIAGNOSTICO, PROGNOSTICO E DIAGNOSTICO DIFERENCIALSSJ e NET sao diagnosticadas primariamente por meio de clínica característica descrita anteriormente e corroboradas pela história recente de administraçao de fármacos causadores em associaçao ao exame físico. No entanto, o diagnóstico deve ser confirmado pela análise histopatológica do tecido lesado, sendo que lesoes em estágio inicial demonstram queratinócitos necrosados distribuídos pela epiderme, enquanto lesoes de estágios tardios revelam necrose epidérmica total e confluente, culminando na formaçao de bolhas subepidérmicas, nao se observando alteraçoes importantes na derme subjacente16. Recentemente, Quinn et al.27 demonstraram uma variedade de infiltrados de células mononucleares na derme, que oscilam entre o esparso e denso; tais padroes de densidade do infiltrado correlacionam-se com a gravidade da doença. Dessa forma, extenso infiltrado de células mononucleares associa-se com taxa de mortalidade de 71%. Caso seja moderado, a taxa é reduzida para 53% e, por último, caso o infiltrado seja esparso, a taxa é de 27%27. A quantificaçao do infiltrado de células mononucleares possui precisao tao confiável acerca do prognóstico quanto o SCORTEN27.
O referido método SCORTEN representa uma forma de mensurar a gravidade da doença, que pode ser utilizada para definir o prognóstico ao incorporar sete variáveis clínicas: idade, malignidade, área de superfície corporal, frequência cardíaca, ureia sérica, bicarbonato e glicose28.
De suma importância mencionar que a biópsia cutânea associada ao exame histopatológico ainda exclui causas capazes de mimetizar a apresentaçao clínica da NET e da SSJ, que possuem tratamento específico, como, por exemplo: síndrome da pele escaldada estafilocócica, pênfigo paraneoplásico, doença enxerto versus hospedeiro, penfigo e penfigoide induzido por fármacos e pustulose exantemática generalizada29.
TRATAMENTOO primeiro e principal elemento que compoe o tratamento da NET e da SSJ é representado pela simples retirada do fármaco causador30. Tal descontinuaçao do medicamento reduz o estímulo inicial para a apoptose; no entanto, metabólitos de drogas que possuem longa meia-vida podem persistir e, dessa forma, reduzir a sobrevida30. O próximo passo essencial para o manejo de tais pacientes é baseado na sua admissao em unidades intensivas de grandes queimados, onde se oferece tratamento e medidas gerais especiais a extensas injúrias cutâneas e ao acometimento sistêmico da doença, como: correçao de possíveis distúrbios hidroeletrolíticos, manutençao volêmica, monitoramento da funçao respiratória e aporte nutricional, além da importante prevençao de infecçoes cutâneas e sistêmicas, sendo que estudos retrospectivos sugerem que a admissao precoce em tais centros de tratamento é capaz de diminuir as infecçoes, assim como a mortalidade relacionada a tais processos infecciosos e permanência hospitalar31,32.
Reposiçao intravenosa de fluidos deve ser realizada utilizandose cristaloides, sendo válido mencionar que a maioria dos autores avalia o montante de líquido a ser administrado pela fórmula de Parkland e soluçao de ringer lactato é usada conforme o manejo de grandes queimados33. Todavia, outra vertente de pensamento discorda, afirmando que a reposiçao de fluidos nao necessita ser tao agressiva quanto aquela efetuada em pacientes com queimaduras extensas, em decorrência da diferença entre a quantidade de líquido exsudado, a ausência do fenômeno do terceiro espaço e a escassez de alteraçoes na permeabilidade vascular generalizada33.
Vital mencionar que existem estudos que recomendam, em pacientes incapazes de se alimentar devido ao intenso acometimento da doença, a nutriçao parenteral total, justificada pelo fato de que a absorçao de nutrientes pode estar modificada devido ao potencial de atingir a mucosa gastrointestinal apresentado pela NET e SSJ32. Além do fato comprometedor mencionado anteriormente, a possibilidade de haver ulceraçoes orofaríngeas e consequente dor pode causar dificuldades na ingesta de alimentos e líquidos, e posicionamento do tubo enteral34. Importante salientar que experimentos realizados com animais revelam benefícios na alimentaçao parenteral no tratamento de extensas lesoes cutâneas, assim como associa-se a vantagem na sobrevida e sobrevivência32.
Deve-se atentar para o fato de que vários pacientes possuem acometimento ocular, sendo essencial o acompanhamento pelo oftalmologista, com o intuito de minimizar danos oculares por meio de tratamentos que incluam lubrificantes e antibióticos tópicos e esteroides35. Recomenda-se, ainda, a realizaçao de culturas de sangue, urina, pele e cateteres intravasculares; sendo que os agentes mais responsáveis pela sepse em tais pacientes sao o
Staphylococcus aureus e a
Pseudomonas aeruginosa, esta última principalmente em internaçoes prolongadas20. Apesar do risco de infecçao por tais microrganismo, nao é recomendada antibioticoterapia empírica profilática, pois nao se estebeleceu vantagem na sobrevida dos pacientes32.
Acerca do uso de corticoterapia sistêmica em tais pacientes, é notada sua associaçao com maiores taxas de mortalidade, sepse e internaçoes prolongadas ao ser administrado 48 horas ou mais a partir da admissao36. Todavia, há estudos que demonstram benefícios na pulsoterapia de corticoides em altas doses, nos estágios recentes da doença37.
Em um dos procedimentos utilizados no tratamento da NET e da SSJ, a plasmaférese, todo o volume sanguíneo é removido do paciente, separando o plasma da porçao celular do sangue, a qual será reinfundida com novo plasma ou albumina. Nesse procedimento, ainda há certa controvérsia quanto ao sucesso, tendo resultados de benefícios potenciais em sobrevivência de pacientes38 e resultados de séries de pacientes nos quais a plasmaférese nao ofereceu o efeito desejado39.
No momento, o foco preponderante das pesquisas em tratamento da da NET e da SSJ é o uso da imunoglobulina intravenosa, sendo a terapia em questao baseada no bloqueio do receptor CD 95 (Fas) presente na superfície celular, o qual induz a apoptose dos queratinócitos40. Existem estudos que envolvem o uso desse tratamento utilizando grandes grupos de pacientes. Um destes, de natureza retrospectiva, reuniu 48 pacientes tratados com imunoglobulina intravenosa e suporte entre os anos de 1997 e 200041. O resultado desse estudo mostrou-se animador, apresentando taxa de sobrevivência de 88%, com dose recomendada de imunoglobulina intravenosa de 1 g/kg/dia, durante 3 dias41. Há evidência de que esse tratamento também auxilie o combate infecçoes e possa afetar o balanço de fluidos em tais pacientes de maneira favorável42.
Outros tratamentos descritos, porém nao recomendados, envolvem os seguintes fármacos: ciclofosfamida, ciclosporina e agentes anti-TNF, como a talidomida (excesso de mortalidade)43.
CONCLUSAOEm decorrência de seu carater raro e correlacionado à exposiçao a medicamentos, NET e SSJ devem ser identificadas precocemente e referidas a centros de tratamento de grandes queimados para tratamento adequado, evitando, dessa forma, sequela a longo prazo e prevenindo a mortalidade por meio de análise médica multidisciplinar, a fim de evitar danos mucocutâneos graves e infecçoes.
REFERENCIAS1. Yarbrough DR 3
rd. Experience with toxic epidermal necrolysis treated in a burn center. J Burn Care Rehabil. 1996;17(1):30-3.
2. Brambilla G, Brucato F, Angrisano A, Palmieri G. Treatment of toxic epidermal necrolysis (TEN). Ann Burns Fire Disasters. 2002;15(1):17-21.
3. Fagan S, Spies M, Hollyoak M, Muller MJ, Goodwin CW, Herndon DN. Exfoliative and necrotizing diseases of the skin. In: Herndon DN, ed. Total burn care. 3
rd ed. Philadelphia:Saunders-Elsevier;2007. p.554-65.
4. Borchers AT, Lee JL, Naguwa SM, Cheema GS, Gershwin ME. Stevens- Johnson syndrome and toxic epidermal necrolysis. Autoimmun Rev. 2008;7(8):598-605.
5. Lissia M, Mulas P, Bulla A, Rubino C. Toxic epidermal necrolysis (Lyell's disease). Burns. 2010;36(2):152-63.
6. Lam NS, Yang YH, Wang LC, Lin YT, Chiang BL. Clinical characteristics of childhood erythema multiforme, Stevens-Johnson syndrome and toxic epidermal necrolysis in Taiwanese children. J Microbiol Immunol Infec. 2004;37(6):366-70.
7. Chung WH, Hung SI, Hong HS, Hsih MS, Yang LC, Ho HC, et al. Medical genetics: a marker for Stevens-Johnson syndrome. Nature. 2004;428(6892):486.
8. Hung SI, Chung WH, Liou LB, Chu CC, Lin M, Huang HP, et al. HLA-B*5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol. Proc Natl Acad Sci USA. 2005;102(11):4134-9.
9. Locharernkul C, Loplumlert J, Limotai C, Korkij W, Desudchit T, Tongkobpetch S, et al. Carbamazepine and phenytoin induced Stevens-Johnson syndrome is associated with HLA-B*1502 allele in Thai population. Epilepsia. 2008;49(12):2087-91.
10. Man CB, Kwan P, Baum L, Yu E, Lau KM, Cheng AS, et al. Association between HLA-B*1502 allele and antiepileptic drug-induced cutaneous reactions in Han Chinese. Epilepsia. 2007;48(5):1015-8.
11. United States Food and Drug Administration. Information for healthcare professionals: dangerous or even fatal skin reactions - carbamazepine. Disponível em: http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm124718.htm. Acesso em: 16/11/2011.
12. Wu Y, Sanderson JP, Farrell J, Drummond NS, Hanson A, Bowkett E, et al. Activation of T cells by carbamazepine and carbamazepine metabolites. J Allergy Clin Immunol. 2006;118(1):233-41.
13. Kaniwa N, Saito Y, Aihara M, Matsunaga K, Tohkin M, Kurose K, et al. HLA-B locus in Japanese patients with anti-epileptics and allopurinolrelated Stevens-Johnson syndrome and toxic epidermal necrolysis. Pharmacogenomics. 2008;9(11):1617-22.
14. Lonjou C, Borot N, Sekula P, Ledger N, Thomas L, Halevy S, et al. A European study of HLA-B in Stevens-Johnson syndrome and toxic epidermal necrolysis related to five high-risk drugs. Pharmacogenet Genomics. 2008;18(2):99-107.
15. Tassaneeyakul W, Jantararoungtong T, Chen P, Lin PY, Tiamkao S, Khunarkornsiri U, et al. Strong association between HLA-B*5801 and allopurinol- induced Stevens-Johnson syndrome and toxic epidermal necrolysis in a Thai population. Pharmacogenet Genomics. 2009;19(9):704-9.
16. Becker DS. Toxic epidermal necrolysis. Lancet. 1998;351(9113):1417-20.
17. Prendiville JS, Hebert AA, Greenwald MJ, Esterly NB. Management of Stevens-Johnson syndrome and toxic epidermal necrolysis in children. J Pediatr. 1987;115(6):881-7.
18. Mukasa Y, Craven N. Management of toxic epidermal necrolysis and related syndromes. Postgrad Med J. 2008;84(988):60-5.
19. Parsons JM. Toxic epidermal necrolysis. Int J Dermatol. 1992;31(11): 749-68.
20. Revuz J, Penson D, Roujeau JC, Guillaume JC, Payne CR, Wechsler J, et al. Toxic epidermal necrolysis. Clinical findings and prognostic factors in 87 patients. Arch Dermatol. 1987;123(9):1160-5.
21. Rasmussen JE. Erythema multiforme. Should anyone care about the standards of care? Arch Dermatol. 1995;131(6):726-9.
22. Roujeau JC, Chosidow O, Saiag P, Guillaume JC. Toxic epidermal necrolysis (Lyell syndrome). J Am Acad Dermatol. 1990;23(6 Pt 1):1039-58.
23. Rasmussen J. Toxic epidermal necrolysis. Med Clin North Am. 1980;64(5):901-20.
24. Pereira FA, Mudgil AV, Rosmarin DM. Toxic epidermal necrolysis. J Am Acad Dermatol. 2007;56(2):181-200.
25. Letko E, Papaliodis DN, Papaliodis GN, Daoud YJ, Ahmed AR, Foster CS. Stevens-Johnson syndrome and toxic epidermal necrolysis: a review of the literature. Ann Allergy Asthma Immunol. 2005;94(4):419-36.
26. Roujeau JC, Stern RS. Severe adverse cutaneous reactions to drugs. N Engl J Med. 1994;331(19):1272-85.
27. Quinn AM, Brown K, Bonish BK, Curry J, Gordon KB, Sinacore J, et al. Uncovering histologic criteria with prognostic significance in toxic epidermal necrolysis. Arch Dermatol. 2005;141(6):683-7.
28. Bastuji-Garin S, Fouchard N, Bertocchi M, Roujeau JC, Revuz J, Wolkenstein P. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol. 2000;115(2):149-53.
29. Bachot N, Roujeau JC. Differential diagnosis of severe cutaneous drug eruptions. Am J Clin Dermatol. 2003;4(8):561-72.
30. Garcia-Doval I, LeCleach L, Bocquet H, Otero XL, Roujeau JC. Toxic epidermal necrolysis and Stevens-Johnson syndrome: does early withdrawal of causative drugs decrease the risk of death? Arch Dermatol. 2000;136(3):323-7.
31. Chave TA, Mortimer NJ, Sladden MJ, Hall AP, Hutchinson PE. Toxic epidermal necrolysis: current evidence, practical management and future directions. Br J Dermatol. 2005;153(2):241-53.
32. Palmieri TL, Greenhalgh DG, Saffle JR, Spence RJ, Peck MD, Jeng JC, et al. A multicenter review of toxic epidermal necrolysis treated in U.S. burn centers at the end of the twentieth century. J Burn Care Rehabil. 2002;23(2):87-96.
33. Gravante G, Esposito G, Piazzolla M, Marianetti M, Delogu D, Montone A. Nutrition of toxic epidermal necrolysis. J Hum Nutr Diet. 2006;19(2):152-3.
34. Kreis BE, Middelkoop E, Vloemans AF, Kreis RW. The use of a PEG tube in a burn centre. Burns. 2002;28(2):191-7.
35. Abood GJ, Nickoloff BJ, Gamelli RL. Treatment strategies in toxic epidermal necrolysis syndrome: where are we at? J Burn Care Res. 2008;29(1):269-76.
36. Engelhardt SL, Schurr MJ, Helgerson RB. Toxic epidermal necrolysis: an analysis of referral patterns and steroid usage. J Burn Care Rehabil. 1997;18(6):520-4.
37. Van der Meer JB, Schuttelaar ML, Toth GG, Kardaun SH, Beerthuizen G, de Jong MC, et al. Successful dexamethasone pulse therapy in a toxic epidermal necrolysis (TEN) patient featuring recurrent TEN to oxazepam. Clin Exp Dermatol. 2001;26(8):654-6.
38. Bamichas G, Natse T, Christidou F, Stangou M, Karagianni A, Koukourikos S, et al. Plasma exchange in patients with toxic epidermal necrolysis. Ther Apher. 2002;6(3):225-8.
39. Sakellariou G, Koukoudis P, Karpouzas J, Alexopoulos E, Papadopoulou D, Chrisomalis F, et al. Plasma exchange (PE) treatment in drug-induced toxic epidermal necrolysis (TEN). Int J Artif Organs. 1991;14(10):634-8.
40. Viard I, Wehrli P, Bullani R, Schneider P, Holler N, Salomon D, et al. Inhibition of toxic epidermal necrolysis by blockade of CD95 with human intravenous immunoglobulin. Science. 1998;282(5388):490-3.
41. Prins C, Kerdel FA, Padilla RS, Hunziker T, Chimenti S, Viard I, et al. Treatment of toxic epidermal necrolysis with high-dose intravenous immunoglobulins: multicenter retrospective analysis of 48 consecutive cases. Arch Dermatol. 2003;139(1):26-32.
42. Craven NM. Toxic epidermal necrolysis. In: Jolles S, ed. Intravenous immunoglobulin in dermatology. London:Martin Dunitz;2003. p.79-92.
43. Ellis MW, Oster CN, Turiansky GW, Blanchard JR. A case report and a proposed algorithm for the transfer of patients with Stevens-Johnson syndrome and toxic epidermal necrolysis to a burn center. Mil Med. 2002;167(8):701-4.
1. Interno do Décimo Segundo período de Medicina da Universidade Gama Filho - RJ, monitor de Dermatologia da Universidade Gama Filho, Rio de Janeiro, RJ, Brasil.
2. Médica estagiária do Serviço de Dermatologia da Policlínica do Rio de Janeiro, Rio de Janeiro, RJ, Brasil.
3. Chefe do Centro de Tratamento de Queimado Adulto (CTQ-A) do Hospital Municipal Souza Aguiar - Rio de Janeiro. Coordenadora Clínica do Centro de Tratamento de Queimado (CTQ) do Hospital Federal do Andaraí - Rio de Janeiro. Professora do Internato (Módulo Queimaduras) da Universidade Gama Filho, Instrutora do Curso Nacional de Normatizaçao ao Atendimento do Queimado (CNNAQ) da SBQ e Curso ABIQ da FELAQ; Rio de Janeiro, RJ, Brasil.
Correspondência:
Felipe Ladeira de Oliveira
Rua Conselheiro Autran, 35/805 - Vila Isabel
Rio de Janeiro, RJ, Brasil - CEP 20551-060
E-mail: oliveiraflmed@gmail.com
Artigo recebido: 30/11/2011
Artigo aceito: 11/2/2012
Trabalho realizado no Centro de Tratamento de Queimado Adulto (CTQ-A) do Hospital Municipal Souza Aguiar, Rio de Janeiro, RJ, Brasil.