RESUMO
OBJETIVO: Caracterizar los casos atendidos en el Hospital Universitario y Politécnico la Fe de Valencia, España, en el transcurso de 7 años de uso de un protocolo quirúrgico para pacientes con quemaduras de más del 50% de superfície corporal quemada (SCQ).
Métodos: Se ha realizado un análisis descriptivo de los pacientes con quemaduras mayores al 50% de SCQ, tratados entre enero de 2011 y enero de 2017, en la Unidad de Quemados del Hospital La Fe (Valencia, España). Todos los pacientes fueron tratados de acuerdo al protocolo quirúrgico establecido en nuestra unidad para el paciente gran quemado.
RESULTADOS: Se trataron 35 pacientes, 25 varones y 10 mujeres, con edad media de 51,3±16,2 años. La llama fue el agente lesional más frecuente. La SC media afecta por quemadura fue 66,9±13,5%. La tasa de mortalidad (TM) neta fue del 55%, siendo el shock por quemadura la causa de muerte predominante en las primeras 48h y la sepsis tras las 48h.
Conclusiones: El paciente gran quemado supone un reto terapéutico donde un enfoque multidisciplinar es determinante para su adecuada evolución. En nuestra serie, la estandarización del tratamiento quirúrgico mediante un protocolo ha permitido un adecuado manejo de los pacientes con una TM inferior a la estimada y comparable a la informada en la literatura.
Palavras-chave:
Quemaduras. Unidades de Quemados. Procedimientos Quirúrgicos Operativos.
ABSTRACT
OBJECTIVE: To characterize the cases treated at the University and Polytechnic la Fe Hospital in Valencia, Spain, over the course of 7 years with the use of a surgical protocol for patients with burns greater than 50% of total body surface area (TBSA).
METHODS: From January 2011 to January 2017, 35 patients with burns greater than 50% TBSA were treated in our Burn Unit. All patients were treated according to our major burn surgical protocol.
RESULTS: A total of 35 patients were treated, 25 men and 10 women, with a mean age of 51.3±16.2 years. Flame burn was the most common etiology. The mean TBSA affected was 66.9±13.5%. The mortality rate was 55%, with burn shock being the main cause of death in the first 48 hours.
CONCLUSION: Patients with burns greater than 50% TBSA suppose a therapeutic challenge where a multidisciplinary approach is essential for its adequate evolution. In our series, the treatment standardization with a protocol has allowed an adequate management of the patients with a mortality rate similar to the literature report and lower than our estimated rate.
Keywords:
Burns. Burn Units. Surgical Procedures, Operative.
INTRODUCIONEl tratamiento inicial del paciente gran quemado es una tarea que implica la coordinación de múltiples profesionales, con el objetivo de alcanzar las mayores tasas de supervivencia con la mínima morbilidad. La importante respuesta sistémica que se produce tras la quemadura, la falta de piel autóloga, la necesidad de largas y numerosas intervenciones, y el gran riesgo de complicaciones
1, convierten su tratamiento en un importante reto que requiere una amplia experiencia en el manejo de pacientes quemados y compresión de su fisiopatología
2.
Los avances logrados en las últimas décadas en el manejo del paciente gran quemado, han mejorado drásticamente sus tasas de supervivencia. Principalmente a expensas del desarrollo y avance en los protocolos de resucitación, soporte respiratorio, metabólico y nutricional, control de las infecciones, así como a una actuación quirúrgica precoz
3. La existencia de directrices mediante guías clínicas ha demostrado mejorar la calidad del tratamiento y la mortalidad de los pacientes
4.
No obstante, en el momento actual no se dispone de guías clínicas con evidencia científica para el manejo del paciente gran quemado que permita estandarizar su tratamiento médico-quirúrgico. Con este artículo queremos mostrar nuestra experiencia en los últimos 7 años mediante la utilización de un protocolo quirúrgico de actuación ante pacientes con quemaduras mayores al 50% de su superficie corporal.
MÉTODORealizamos un análisis descriptivo de los pacientes con quemadura mayor al 50% de SC tratados en la Unidad de Quemados del Hospital Universitario y Politécnico La Fe (Valencia, España), en el periodo comprendido entre enero de 2011 y enero de 2017. Como único criterio de exclusión, la ausencia de registro de las variables de interés en la historia clínica.
Se recogieron datos de 35 pacientes de forma retrospectiva y de acuerdo a las normas establecidas por el Comité de Ética de nuestro hospital para la preservación de la privacidad de los pacientes, registrándose las variables edad, género, mecanismo de lesión, área de quemadura, existencia de lesión por inhalación, tipo de cobertura cutánea, índice de gravedad ABSI (Abbreviate Burn Severit Index), mortalidad y causa de muerte. Los datos recogidos fueron analizados utilizando el programa de análisis estadístico R-Commander.
Tras su estabilización, todos los pacientes fueron tratados en base al protocolo quirúrgico establecido en nuestra unidad para el paciente gran quemado (Flujograma 1), siempre ajustado a las necesidades individuales de cada paciente en función de sus características y las circunstancias de la quemadura. También fueron consideradas las características particulares de las regiones afectas (Tabla 1).
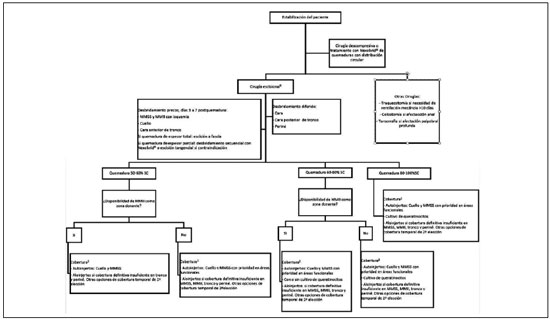 Flujograma 1
Flujograma 1 - Algoritmo protocolo quirúrgico gran quemado. MMSS, miembros superiores; MMII, miembros inferiores.
* Se trata de un algoritmo exclusivamente orientativo, es imperativo individualizar y adaptar los tiempos, y opciones de tratamiento quirúrgico en función de las
características y circunstancias de cada paciente. 1 Se llevará a cabo el desbridamiento de la máxima extensión de quemadura posible de forma precoz. 2 Si el
paciente se encuentra en tratamiento con dosis elevadas de drogas vasoactivas, se recomienda diferir la cobertura definitiva a intervenciones posteriores.
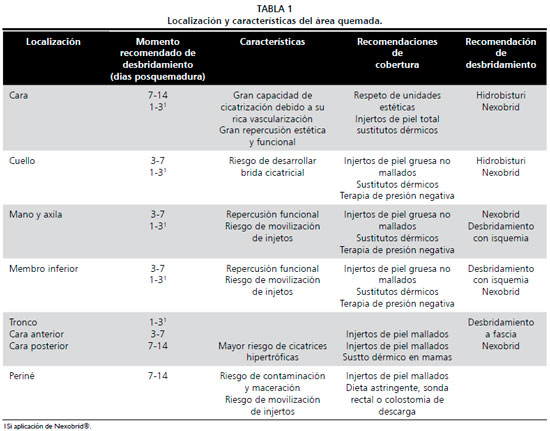
De acuerdo a dicho protocolo, los pacientes fueron sometidos inicialmente a una valoración objetiva evaluando la necesidad de actuación descompresiva y de realización de traqueostomía, colostomía o tarsorrafia. Seguidamente se realizó un desbridamiento quirúrgico precoz de cuello, miembros y cara anterior de tronco, entre los 3 y 7 días postquemadura. De forma diferida se llevó a cabo el desbridamiento de quemaduras en cara, cara posterior de tronco y periné. La cobertura inicial en pacientes con un 50%-60% de SC quemada, con disponibilidad de miembros inferiores como zona donante, se realizó mediante autoinjertos priorizando la cobertura de áreas funcionales como cuello y miembros superiores. En el caso de no disponer de suficiente área donante se realizó la cobertura de las áreas escindidas mediante aloinjertos o Biobrane
® como segunda elección.
En el caso de pacientes con mayor extensión de quemadura, las opciones de cobertura utilizadas ante la escasez de áreas donantes fueron los autoinjertos disponibles, priorizando la cobertura de áreas funcionales, los cultivos de queratinocitos y aloinjertos.
RESULTADOSSe analizaron un total de 35 pacientes, 25 varones y 10 mujeres, con una edad media de 51.3±16.2 años. La causa de la lesión fue la quemadura por llama en 23 de ellos, deflagración en 9, corriente eléctrica en 1 y escaldadura en 2 pacientes. La superficie corporal media afecta por quemadura fue de 66.9±13.5% (Tabla 2). Fallecieron un total de 20 pacientes, 12 de ellos en las primeras 48h a causa del shock por quemadura. Los 8 restantes fallecieron pasadas las primeras 48 horas a causa de shock séptico. La tasa de mortalidad neta fue del 55%. Excluyendo a los pacientes fallecidos en las primeras 48h disminuye hasta el 35%. Su relación con la edad y la SC quemada de los pacientes se describe en la Tabla 3, con un mortalidad del 100% en los pacientes mayores de 66 años con SC quemada mayor al 65%. La relación entre las tasas de mortalidad registradas y las tasas de mortalidad estimadas según el índice ABSI se muestra en la Figura 1, siendo las primeras inferiores a las estimadas para pacientes con porcentaje de quemadura inferior al 80% de SC.
Respecto al tratamiento quirúrgico, 12 pacientes fallecieron antes de la intervención (34%). En 7 pacientes se llevó a cabo la cobertura únicamente mediante autoinjertos (20%) y en los 16 restantes fue necesaria la utilización de opciones de cobertura temporal como aloinjertos y Biobrane
® (46%).
DISCUSIONEl paciente gran quemado presenta una elevada mortalidad, siendo la sepsis, el daño por inhalación y el shock por quemadura las tres principales causas de muerte en este tipo de pacientes
5. La tasa de mortalidad registrada en EEUU entre 2006 y 2015 en pacientes con quemaduras de extensión superior al 50% de SC, fue del 56%
6, cifra comparable a la observada en nuestra serie de pacientes.
Además en comparación con las tasas de mortalidad estimadas según el índice ABSI, las tasas de mortalidad real que observamos fueron menores en pacientes con quemadura inferior al 80% de SC. El índice ABSI, pese a sus limitaciones, se ha mostrado útil en la estimación de mortalidad en el paciente quemado crítico en comparación con el resto de escalas
7.
Dentro de los factores que han contribuido a la reducción de su mortalidad, se encuentra como factor quirúrgico la escisión precoz de la quemadura. Esta permite la eliminación de tejido necrótico, disminuyendo la reacción inflamatoria y la colonización bacteriana, preservando el tejido viable subyacente
8.
Aunque existe un amplio consenso, el momento concreto para llevarla a cabo aún falta por determinar. Éste depende de factores logísticos y de la estabilidad del paciente, a su vez determinada por la extensión y profundidad de la quemadura, edad, comorbilidades y afectación de la vía aérea, entre otros.
Si existen condiciones favorables, se recomienda llevar a cabo la intervención quirúrgica dentro de los primeros 7 días, sin haberse encontrado diferencias estadísticamente significativas en cuanto a tasas de infección y mortalidad dentro de ese periodo
9. Todos los pacientes de nuestro estudio fueron sometidos a desbridamiento quirúrgico entre los 3 y 7 días posteriores a la quemadura.
Existen distintas modalidades de desbridamiento, siendo la escisión tangencial mediante dermatomo la más ampliamente utilizada hasta la fecha. Su realización sobre grandes superficies puede provocar una gran pérdida hemática, por lo que conviene adoptar medidas que limiten el sangrado: escisión muy temprana, uso de torniquetes en extremidades, escisión hasta plano fascial e infiltración previa con solución débil de adrenalina
8. La utilización de hidrobisturí permite un desbridamiento rápido y preciso de áreas pequeñas y con difícil acceso
10. Otro novedoso método no quirúrgico es el desbridante enzimático Nexobrid
®. Se trata de un concentrado de enzimas proteolíticas enriquecido con bromelaina, que logra una eliminación rápida y selectiva de la quemadura con preservación de la dermis no lesionada. Se ha mostrado eficaz en la prevención de desarrollo de síndrome compartimental secundario a quemaduras profundas de distribución circular
11.
Cuenta con la limitación de aplicación, según ficha técnica, a áreas de quemadura de hasta el 15% de SC. Nuestra experiencia con este tratamiento se extiende a los últimos cuatro años, y en el momento actual ya se ha iniciado su aplicación en distintas Unidades de Quemados de nuestro país, realizando desbridamientos secuenciales del 15-20% de SC a partir del segundo día postquemadura. Esto ha permitido lograr un desbridamiento eficaz de grandes extensiones sin la morbilidad asociada a las transfusiones múltiples que el método clásico de desbridamiento quirúrgico lleva implícito.
El objetivo de la estrategia quirúrgica debe ser eliminar el tejido necrótico lo más precozmente posible y asegurar su cobertura definitiva. Extensiones superiores al 80% de SC quemada, siendo más del 50% de espesor total, condicionan una especial dificultad terapéutica debido a la escasez de áreas donantes
12.
De acuerdo al protocolo establecido en nuestra unidad, en todos los pacientes se comenzó con la cobertura de áreas funcionales y de importancia estética con injertos no mallados. El desbridamiento del resto de las áreas afectas se estableció en función de la disponibilidad de superficie donante, si se pretendía una cobertura definitiva, o en función de las distintas opciones de cobertura temporal existentes.
En cuanto a las opciones de cobertura, desde su descripción por Reverdin en 1871, los injertos de piel autóloga siguen constituyendo la piedra angular en el tratamiento del paciente quemado
13. Sus diferentes modalidades de utilización, de espesor parcial o total, mallado o no mallado, mediante técnica sándwich en injertos con gran tasa de expansión o técnica Meek recomendada para expansiones superiores a 1:3
14, están condicionadas en gran parte al tipo y tamaño de área a tratar y al tamaño de área donante disponible. Por todo ello, ha constituido la cobertura de elección en todos los pacientes de nuestro estudio, únicamente condicionada a su disponibilidad.
Otra de las opciones de cobertura definitiva disponibles en la actualidad es el cultivo de queratinocitos. A partir de una biopsia cutánea del paciente se obtiene un equivalente cutáneo autólogo bicapa. Está constituido por una capa interna a modo de dermis formada por plasma, plaquetas y fibroblastos, y una capa externa a modo de epidermis con queratinocitos sembrados en distintos grado de maduración
15.
Los principales inconvenientes de esta técnica son el tiempo de fabricación (3 semanas desde la toma de biopsia), su elevado coste y una tasa de prendimiento inferior al autoinjerto, oscilando entre 50 y 90% según las series
16. Desde el año 2013 en nuestro país es considerado medicamento por la Agencia Española del Medicamento y Productos Sanitarios, lo que ha encarecido su producción y limitado su disponibilidad. En nuestro caso su uso se plantea habitualmente en pacientes con extensión de quemadura superior al 60% de SC, dada la limitación existente de áreas donantes en estos casos.
Cuando la piel sana del paciente no es suficiente para la cobertura de las áreas desbridadas, se recurre a una cobertura temporal. Los aloinjertos son una de las opciones más utilizadas, reducen las tasas de infección, las pérdidas por evaporación, el dolor y favorecen la cicatrización al proporcionar un ambiente húmedo, protegido y libre de trauma mecánico y la desecación
17.
En cuanto a las limitaciones y riesgos, cabe destacar su coste elevado, sobre todo a expensas de las medidas de procesamiento, su disponibilidad y su riesgo bajo, pero existente, de transmisión de enfermedades infecciosas. Constituye la primera opción de cobertura temporal en nuestro protocolo. Dentro de los sustitutos sintéticos, Biobrane
® (Smith &Nephew, United Kingdom) aporta una cobertura adecuada pero durante un tiempo inferior al de los aloinjertos, con el inconveniente de su susceptibilidad infecciosa
18.
La cobertura de las áreas funcionales merece un trato especial debido a su importante repercusión en la morbilidad final. Autores como Gi-Yeun Hur et al. muestran la eficacia de la utilización de sustitutos dérmicos en la "prevención" de la formación de contracturas, al reducir su formación en los primeros 3-6 meses gracias, entre otros factores, a la elastina aportada que regula la contracción del colágeno e interrumpe la diferenciación de los miofibroblastos
19.
Otro beneficio potencial de la utilización de sustitutos dérmicos como Matriderm
® o Integra
®, se localiza en el área donante de injerto de piel, al requerir injertos de piel parcial de menor grosor al habitual, se consigue un menor tiempo de epitelización y una menor morbilidad del área donante
19. La terapia de presión negativa es otra herramienta útil a tener en cuenta en regiones de baja tasa de prendimiento y áreas funcionales importantes. Reduce la formación de edema, incrementa la perfusión tisular, disminuye la contaminación bacteriana y favorece la inmovilización del injerto y su aposición al lecho de la herida, permitiendo una movilización temprana
20.
En definitiva, las opciones terapéuticas utilizadas deben tratar de disminuir la morbilidad y las secuelas en este tipo de pacientes, permitiendo de esta forma alcanzar un adecuado estatus funcional que mejore su calidad de vida posterior. Para ello, además de un adecuado tratamiento quirúrgico, las medidas de prevención como medidas posturales, fisioterapia pasiva y activa y presoterapia, deben estar presentes desde el principio del tratamiento, adaptándose en función de la evolución del paciente y tras cada nuevo acto terapéutico que se lleve a cabo
21.
CONCLUSIONLos pacientes con quemaduras mayores al 50% de SC suponen un reto terapéutico donde un enfoque multidisciplinar es determinante para su adecuada evolución. En nuestra serie, la estandarización del tratamiento quirúrgico mediante este protocolo ha permitido un adecuado manejo de los pacientes con una tasa de mortalidad inferior a la estimada y comparable a la informada en la literatura.
REFERENCIAS1. Kokiso D, Santos NSV Arruda PDM, Gomide NFM, Stanzani FR, Vidal MA. Avaliaçao das variáveis associadas à demora na enxertia do queimado agudo. Rev Bras Queimaduras. 2014;13(4):226-31.
2. Ziegler B, Hirche C, Horter J, Kiefer J, Grützner PA, Kremer T, et al. In view of standardization Part 2: Management of challenges in the initial treatment of burn patients in Burn Centers in Germany, Austria and Switzerland. Burns. 2017;43(2):318-25.
3. Wang Y, Tang HT, Xia ZF Zhu SH, Ma B, Wei W et al. Factors affecting survival in adult patients with massive burns. Burns. 2010;36(1):57-64.
4. Espinosa Brito A, Del Sol Padrón L, Espinosa Roca AA, Garriga Valdés JL, Viera Valdés B. Guías de práctica clínica. Ventajas y desventajas. Medisur. 2009;7(5):44-47.
5. Kallinen O, Maisniemi K, Bohling T, Tukiainen E, Koljonen V Multiple organ failure as a cause of death in patients with severe burns. J Burn Care Res. 2012;33(2):206-11.
6. American Burn Association (ABA). National Burn Repository Report. Chicago: ABA; 2016.
7. Pantet O, Faouzi M, Brusselaers N, Vernay A, Berger MM. Comparison of mortality prediction models and validation of SAPS II in critically ill burns patients. Ann Burns Fire Disasters. 2016;29(2):123-9.
8. Herndon DN. Total Burn Care. 4th ed. Philadelphia: Saunders Elsevier; 2012.
9. Toussaint J, Chung WT, Mc Clain S, Raut V Singer AJ. Optimal Timing for Early Excision in a Deep Partial Thickness Porcine Burn Model. J Burn Care Res. 2017;38(1):e352-8.
10. Kakagia DD, Karadimas EJ. The Efficacy of VersajetTM Hydrosurgery System in Burn Surgery. A Systematic Review. J Burn Care Res. 2018;39(2):188-200.
11. Rosenberg L, Shoham Y Krieger Y, Rubin G, Sander F Koller J, et al. Minimally invasive burn care: a review of seven clinical studies of rapid and selective debridement using a bromelain-based debriding enzyme (Nexobrid
®). Ann Burns Fire Disasters. 2015;28(4):264-74.
12. Tagami T, Matsui H, Fushimi K, Yasunaga H. Validation of the prognostic burn index: a nationwide retrospective study. Burns. 2015;41(6):1169-75.
13. Liu HF, Zhang F Lineaweaver WC. History and Advancement of Burn Treatments. Ann Plast Surg. 2017;78(2 Suppl 1):S2-8.
14. Menon S, Li Z, Harvey JG, Holland AJ. The use of the Meek technique in conjunction with cultured epithelial autograft in the management of major paediatric burns. Burns. 2013;39(4):674-9.
15. González Alaña I, Aguilar Barrón P Torrero López JV Ferreiro González I, Gabilon-do Zubizarreta FJ. Cobertura de grandes quemados con cultivo de queratinocitos: casuística de nuestra Unidad y protocolo de tratamiento. Cir Plást Iberolatinoam. 2012;38(3):257-64.
16. Lootens L, Brusselaers N, Beele H, Monstrey S. Keratinocytes in the treatment of severe burn injury: an update. Int Wound J. 2013;10(1):6-12.
17. Kitala D, Kawecki M, Klama-Baryla A, Labus W Kraut M, et al. Allogeneic vs. Autologous Skin Grafts in the Therapy of Patients with Burn Injuries: A Restrospective, Open-label Clinical Study with Pair Matching. Adv Clin Exp Med. 2016;25(5):923-9.
18. Tan H, Wasiak J, Paul E, Cleland H. Effective use of Biobrane as a temporary wound dressing prior to definitive split-skin graft in the treatment of severe burn: A retrospective analysis. Burns. 2015;41(5):969-76.
19. Hur GY, Seo DK, Lee JW Contracture of skin graft in human burns: Effect of artificial dermis. Burns. 2014;40(8):1497-503.
20. Kamolz LP Lumenta DB, Parvizi D, Wiedner M, Justich I, et al. Skin graft fixation in severe burns: use of topical negative pressure. Ann Burns Fire Disasters. 2014;27(3):141-5.
21. Lamy J, Yassine AH, Gourari A, Forme N, Zakine G. Place des substituts cutanés dans le traitement chirurgical des grands brûlés sur plus de 60 % de la Surface corporelle. Revue de patients sur ll ans dans le centre des brûlés adultes du CHRU de Tours. Ann Chir Plast Esthet. 2015;60(2):131-9.
Recebido em
18 de Fevereiro de 2018.
Aceito em
9 de Março de 2018.
Local de realização do trabalho: Hospital Universitario y Politécnico La Fe, Valencia, Comunidad valenciana, España
Conflito de interesses: Os autores declaram não haver