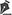RESUMO
INTRODUÇAO: A cobertura e regeneraçao cutânea em queimaduras, trauma, feridas com grandes defeitos da pele e defeitos congênitos do tecido de revestimento tiveram grande progresso nas ultimas décadas na sua resoluçao com os substitutos cutâneos. Dentre eles, a Matriz de Regeneraçao Dérmica (MRD)é um substituto cutâneo permanente, desenvolvido para promover uma cobertura com regeneraçao ordenada da pele. Associado a isso, os Curativos sob Pressao Negativa (CPN) têm sido utilizados para acelerar a maturaçao da MRD, pelo fato de estimularem a angiogênese local e diminuir a incidência de complicaçoes.
OBJETIVO: O objetivo desse estudo é analisar a utilizaçao do CPN como adjuvante no tratamento com MRD no tratamento de feridas em geral, em crianças atendidas no serviço de Cirurgia Pediátrica do Hospital Infantil Joana de Gusmao (HIJG).
MÉTODOS: Foram analisados todos os prontuários de crianças submetidas ao implante de MRD associada ao CPN de janeiro de 2009 a março de 2013, totalizando 54 pacientes. A idade prépúbere (33,33%) e o sexo masculino (62,96%) predominaram.
RESULTADOS: Pacientes queimados com sequela de retraçao cicatriciais e trauma foram as principais indicaçoes de implante de MRD. A complicaçao inicial mais comum foi o hematoma, e a pega total da matriz ocorreu em 83,33% e a pega parcial em 12,96% dos casos. O tempo médio de maturaçao da MRD com a utilizaçao do CPN foi de 14 dias com uma necessidade de troca. A quantidade de trocas de curativos foi, em média, de dois procedimentos.
CONCLUSOES: O CPN oferece vantagens no tratamento adjuvante à MRD, como um menor número de trocas de curativos, reduçao no tempo maturaçao da MRD, e reduçao do tempo de internaçao hospitalar.
Palavras-chave:
Pele Artificial. Cicatrização de Feridas. Queimaduras.
ABSTRACT
INTRODUCTION: Skin coverage and regeneration in burns, trauma, wounds with large skin defects and congenital defects of the skin had great progress in recent decades with skin substitutes. The Dermal Regeneration Template (DRT) is a permanent skin substitute developed to coverage with regeneration of a normal neodermis. The association of DRT with negative pressure (NP) devices has been used to accelerate the maturation of DRT, by local improve of angiogenesis and to reduce the incidence of complications.
OBJECTIVE: The aim of this study is to analyze the use of NP in adjunctive therapy with DRT in the treatment of wounds in children seems at the Pediatric Surgery Department of Joana de Gusmao Children Hospital (HIJG).
METHODS: The records of all children who had implantation of DRT associated with NP between January 2009 and March 2013, totaling 54 patients, were reviewed. The young teenagers (33.33%) and males (62.96%) were more frequent.
RESULTS: Burned patients with cicatricial retraction and trauma were the main indications for DRT implant. Most common early complication was hematoma, and full takes matrix occurred in 83.33% and partial takes in 12.96% of cases. The average maturity of the MRD using the CPN was 14 days and average of the dressing change was only two times.
CONCLUSIONS: The NP offers advantages in the adjuvant treatment of DRT, as fewer dressing changes, reduction in the time of DRT maturation, and reduced length of hospital stay.
Keywords:
Skin, Artificial. Wound Healing. Burns.
INTRODUÇAOEmbora avanços tecnológicos na área médica venham aumentando a sobrevivência de pacientes da populaçao pediátrica nos últimos 20 anos, o manejo de feridas agudas e crônicas de várias etiologias nestes pacientes geralmente se constituem como um desafio
1. Grandes defeitos cutâneos resultantes de injúrias graves frequentemente sao tratados com cirurgias reconstrutivas extensas, as quais sao acompanhadas de longos períodos de hospitalizaçao, além de risco de infecçao e trombose
2.
A maioria das lesoes de partes moles em crianças possui uma significativa morbidade, incluindo trocas frequentes de curativos, ansiedade por parte do paciente e dos familiares em relaçao à dor, longo tempo de internaçao hospitalar e um potencial para a realizaçao de diversos procedimentos cirúrgicos durante o tratamento
3. A importância de reduzir o tempo de fechamento dessas feridas complexas é um aspecto crítico quando estamos lidando com pacientes pediátricos. O retorno do paciente rapidamente às suas atividades rotineiras pode melhorar o bem-estar tanto do paciente como dos membros da família
4.
Desde o final da década de 70, médicos envolvidos no tratamento de portadores de grandes defeitos cutâneos buscaram seu fechamento o mais precoce possível
5. Muitos recursos econômicos e grupos de pesquisa estiveram dedicados, nas duas últimas décadas, à confecçao de projetos objetivando desenvolver substitutos cutâneos para cobrir grandes defeitos da pele. Isso é particularmente importante nos casos de grandes queimaduras, quando o tecido cutâneo autólogo remanescente é insuficiente para a cobertura das lesoes, além dos casos de ressecçoes extensas, feridas crônicas ou revisao cirúrgica de sequelas cicatriciais.
A primeira escolha para o fechamento de feridas é o enxerto autólogo ou a rotaçao de retalhos com tecido do próprio paciente. Uma vez esgotadas as fontes doadoras autóloga e homóloga da pele, deve-se pensar na possibilidade da utilizaçao de algum substituto cutâneo para a cobertura de tais lesoes. Entre as propriedades desses substitutos, é desejável que eles, além de melhorarem as chances de sobrevivência, forneçam uma melhor recuperaçao funcional e estética.
Um grande número de substitutos de pele tem sido desenvolvido ao longo das últimas décadas. Desde a sobreposiçao de aloenxertos de animais até a cultura de queratinócitos autólogos, muitos materiais foram produzidos visando uma maior semelhança com a pele humana
6. Para melhor compreender o processo de desenvolvimento de substitutos cutâneos, é indispensável conhecer a estrutura do maior órgao do corpo humano: a pele, que atinge uma área de superfície de 1,5 m
2 a 2,0 m
2 em adultos e pode atingir até 16% do peso corpóreo
7.
A pele humana consiste em três camadas. A camada mais externa, a epiderme, mede cerca de 0,1 mm-0,2 mm. Queratinócitos e melanócitos sao os tipos celulares mais predominantes na epiderme. A membrana basal separa fisicamente a epiderme da derme, a qual fica logo abaixo, e, funcionalmente, a membrana basal conecta estes dois tecidos
8. A derme é composta de tecido conjuntivo e é responsável pela elasticidade da pele, por ser rica em colágeno e elastina
7.
Os componentes celulares majoritários na derme sao os fibroblastos, que produzem matriz extracelular. O rico sistema de vascularizaçao da derme fornece nutrientes para todos os tipos celulares nela presentes. Os apêndices cutâneos, como folículo piloso, glândulas sebáceas e sudoríparas
8, sao derivados da epiderme, porém encontram-se situados na derme. Estes anexos sao conhecidos como "ilhas de regeneraçao", pois, por possuírem células epidérmicas, promovem a recuperaçao da pele, na ocorrência de lesoes profundas
7. O tecido celular subcutâneo, ou hipoderme, é constituído em sua maior parte de gordura, funcionando como isolamento e como fonte de energia
8.
Assim, os substitutos de pele devem aproximar-se da estrutura original da pele ou pelo menos permitir a regeneraçao de parte dela. Segundo Jaksic & Burke
9, o substituto ideal da pele deve ser aderente, elástico, permitir a passagem de vapor de água, ser durável, fornecer uma barreira antibacteriana, ser atóxico e nao antigênico, antisséptico, homeostático, de fácil aplicaçao e remoçao, e ser de baixo custo. Em 2008, Kumar
10 sugeriu a classificaçao dos substitutos de pele, aprimorando a classificaçao prévia de Balasubrami et al.
11, de 2001, a qual nao se aplicava a todos os produtos disponíveis.
A classe I é representada pelos curativos temporários impermeáveis, os quais nao possuem nenhum componente epidérmico e sao essencialmente impermeáveis. Agem como barreira mecânica à invasao bacteriana e reduzem a perda líquida por evaporaçao. Subdividem-se em:
1) Materiais de camada única:
a) Curativos naturais: membrana amniótica, casca de batata. b) Curativos sintéticos:
(1) Membrana de polímeros sintéticos: Tegaderm
r; Opsite
r; Dermafilm
r.
(2) Espuma ou spray polimérico.
2) Materiais de camada dupla de engenharia de tecidos: Transcyte
r - malha de nylon, coberta por colágeno, semeada com fibroblastos neonatais cultivados
in vitro.
A classe II representa os substitutos de pele duráveis de camada única, os quais sao:
1) Substitutos epidérmicos: Apligraft
r, indicado para tratamento de úlceras crônicas.
2) Substitutos dérmicos: componentes dérmicos de pele processada, ou fabricados com colágeno e outras proteínas de matriz. Produzem cicatrizes de melhor qualidade e minimizam as chances de contratura. Incluem:
a) Membrana de colágeno bovino: Kollagen
r. b) Membrana de colágeno suíno: Permacol
r. c) Matriz dérmica bovina: Matriderm
r - constituído por proteínas extracelulares (colágeno e elastina). É usado em queimaduras de espessura total, associado a enxerto de pele. d) Matriz dérmica humana: Alloderm
r - matriz dérmica acelular com componentes biológicos naturais, derivada de pele humana de cadáver.
Na classe III, encontram-se os seguintes substitutos de pele complexos:
1) Enxerto de pele: aloenxerto (cadáver), xenoenxerto (suíno).
2) Pele de engenharia de tecidos:
a) Integra
r: matriz tridimensional formada por colágeno bovino e glicosaminoglicana, com camada externa de silicone.
b) Biobrane
r: camada externa de silicone e malha de nylon interna com colágeno.
Há ainda produtos cujo princípio é a cultura de queratinócitos autólogos, como Epicell
r e Laserskin
r, desenvolvidos com o intuito de baixar os custos e melhorar a qualidade da epiderme, mas ainda nao sao comercializados
10,12.
Os substitutos de pele, tanto epidérmicos quanto dérmicos, parecem ser uma nova e promissora alternativa no tratamento das queimaduras, na fase aguda como também na remoçao de sequelas. Estas estruturas procuram reconstituir morfológica e funcionalmente a pele normal.
Entre os substitutos de pele mais utilizados em todo o mundo e em uso na prática clínica diária, encontra-se a matriz de regeneraçao dérmica (pele artificial - Integra
r), desenvolvida para utilizaçao em pacientes queimados e descrita por Yannas & Burke, em 1980
13.
Pelas características, o Integra
r trata-se de uma estrutura bilaminar constituída de colágeno bovino e condroitina-6-fosfato (componente dérmico), coberta em sua superfície externa com uma lâmina sintética de silicone, na espessura de 100
µm (componente epidérmico), cuja funçao é impedir a perda de líquidos (0,5 ml/cm2/h). Fisicamente, é uma barreira protetora
14. A matriz de colágeno tem uma estrutura tridimensional, com uma porosidade variável de 50 ± 20
µm
14, aproximando-se da estrutura da pele normal, e é completamente biodegradável após 30 dias
15. Durante este período, ela serve de base para a proliferaçao de fibroblastos e células endoteliais, facilitando a neoformaçao dérmica com funçao semelhante à pele normal
16,17. O diâmetro dos poros é crucial para a incorporaçao de tais células
14.
Inicialmente, as células inflamatórias migram para a matriz e sobrevivem por embebiçao de nutrientes. Com o surgimento da angiogênese, os capilares crescem para dentro da matriz, sustentando a migraçao de células e a elaboraçao da nova derme
18. Em torno de 7 dias, a esponja de colágeno e glicosaminoglicano promove a migraçao de fibroblastos, que começam a produzir mais matriz proteica extracelular e colágeno endógeno
19,20. Após 14 dias, existe uma extensa infiltraçao de células e matriz, preenchendo 2/3 da derme artificial
1. Dependendo da neovascularizaçao formada, a camada de silicone é removida e um enxerto epidérmico extrafino autólogo é aplicado sobre a área cruenta. As células da epiderme proliferam e aderem à neoderme
21.
As indicaçoes para uso da MRD incluem áreas que necessitam de uma pele de melhor qualidade, como pescoço, grandes articulaçoes, maos e mamas, ou em grandes queimados submetidos à excisao tangencial sem área doadora suficiente para o enxerto autólogo
22,23. No serviço de cirurgia pediátrica do Hospital Infantil Joana de Gusmao (HIJG), a MRD vem sendo utilizada no tratamento de queimados desde 2002
24-26, e seu uso está sendo cada vez mais ampliado, como na exérese de nevus congênitos gigantes ou perdas cutâneas por trauma
27.
Como vantagens, a MRD nao apresenta resposta imunológica
28, é estéril, pode ser armazenada por longos períodos, a técnica de implante é relativamente simples, o enxerto epidérmico é fino (menor morbidade da área doadora), apresenta resultados próximos da pele normal e acompanha o crescimento da pele. Como desvantagens, temos o preço elevado, a necessidade de dois procedimentos cirúrgicos, risco de infecçao abaixo da camada de silicone e as altas taxas iniciais de insucesso
12,29,30.
Recentemente, os curativos sob pressao negativa (CPN) têm sido utilizados para acelerar a maturaçao da MRD, pelo fato de estimularem a angiogênese local. O curativo a vácuo tem sido citado frequentemente na literatura como uma excelente alternativa para o tratamento de feridas e tem sido indicado para uma variedade de lesoes que incluem feridas agudas, como fraturas expostas, lesoes extensas de partes moles, queimaduras, ressecçoes cirúrgicas, e feridas crônicas, como escaras, infecçoes e deiscência de feridas operatórias, entre outras
3,31-34.
Na tentativa de proteger e ainda acelerar o processo de cicatrizaçao é que surgiu o CPN. Ele foi primariamente descrito por Argenta & Morykwas
35 e Morykwas et al.
36, no ano de 1997. E Consiste na aplicaçao de uma esponja estéril na cavidade da ferida, instalaçao de um envoltório plástico adesivo sobre a esponja, que gera um sistema selado onde entao é aplicada pressao sub atmosférica através de um tubo rígido conectado a um aspirador.
Os mecanismos de açao do curativo sobre a lesao sao: reduçao do edema intersticial, reduçao da infecçao, stress mecânico e estímulo a angiogênese.
Reduçao do edema intersticial: O edema intersticial presente na lesao prejudica a microvasculatura e o sistema linfático, o que sobrecarrega os capilares e veias. A pressao local leva a um déficit circulatório, o que diminui a oferta de oxigênio, nutrientes e fatores de crescimento. Com a sobrecarga do sistema linfático e venoso, leva a uma reduçao na drenagem de fatores inibitórios (proteases, como as elastases) e endotoxinas bacterianas
35. Com a pressao negativa sendo aplicada sobre a ferida, atinge-se uma remoçao macroscópica do fluido intersticial
37, gerando uma reduçao no turgor tecidual, fazendo com que a sobrecarga venosa diminua. Dessa forma, gera-se um aumento no fluxo sanguíneo local
36 e uma melhor perfusao da ferida.
Reduçao da InfecçaoCom o incremento da vasculatura e oxigenaçao local, reduz-se a colonizaçao por organismos anaeróbios
35 e a disponibilidade de oxigênio leva a um aumento na funçao dos neutrófilos e subsequente aumento na resistência a infecçao por meio da produçao de radicais oxidativos antibactericidas
38. Morykwas et al.
36 demonstraram a diminuiçao da colonizaçao bacteriana em tecido porcino infectado (108 bactérias/grama de tecido) comparado a ferimentos controle. Estudos em humanos confirmaram, mostrando reduçao da colonizaçao bacteriana em feridas submetidas ao curativo sob pressao negativa, a níveis clínicos de 102-103/grama de tecido.
Estímulo à angiogêneseAs forças mecânicas possuem um potencial conhecido de estimularem a angiogênese
35,39-41, promoverem a liberaçao de segundos mensageiros e estimularem a proliferaçao endotelial. Dessa forma, encontrou-se uma densidade capilar aumentada em ferimentos tratados com terapia de pressao negativa em relaçao a ferimentos controle
42.
As secreçoes da ferida também possuem quantidade aumentada de proteases, que dificultam a cicatrizaçao da ferida. Formam, assim, um ambiente hostil à angiogênese e à proliferaçao de queratinócitos, fibroblastos e células endoteliais
43. A terapia de pressao negativa, por drenar essas secreçoes ricas em proteases e metaloproteases
40, estimula a angiogênese e a cicatrizaçao do ferimento.
Aproximaçao dos bordos da feridaA orientaçao do curativo permite aplicar uma força uniforme na superfície da ferida. Gera também uma força centrípeta, que aproxima os bordos da ferida, reduzindo seu tamanho. A carga gerada permite a proliferaçao tecidual local, pelo mesmo mecanismo que encontramos na expansao tecidual e no método de Ilizarov. Sugere-se que a aplicaçao de Terapia sob Pressao Negativa, causando pressao local externa ao ferimento, gera um aumento na proliferaçao de fibroblastos e células endoteliais, levando à produçao de colágeno e estímulo à angiogênese. Os mecanismos que explicam esse estímulo sao a liberaçao de íons de cálcio, inositol-trifosfato e creatinofosfoquinases pela açao de stresse sobre a parede celular
36,39,44.
No Hospital Infantil Joana de Gusmao, este tipo de curativo tem sido indicado, conforme recomenda a literatura pertinente, para vários tipos de lesoes como queimaduras, ressecçoes de cicatrizes hipertróficas, fraturas expostas, lesoes extensas de partes moles, escaras, deiscência de feridas operatórias e como terapia adjuvante na maturaçao da matriz de regeneraçao dérmica.
A comunidade científica vem fazendo pesquisas com o CPN há muito tempo, e já se descobriu muitas qualidades e benefícios na utilizaçao da técnica. Porém, por ser uma técnica relativamente nova, um número maior de estudos a respeito do curativo ainda sao necessários
41.
A terapia com pressao negativa tem sido empregada em associaçao à MRD com o objetivo de melhorar o tempo de angiogênese
45, reduzindo, assim, o tempo da vascularizaçao completa do enxerto (3-6 semanas). Dessa forma, poderiam ser reduzidos os custos hospitalares, os riscos de complicaçoes associados com os procedimentos cirúrgicos e, finalmente, o tempo em que o paciente ficaria disponível à biointegraçao do seu enxerto.
ObjetivoAnalisar os resultados obtidos com a utilizaçao do curativo sob pressao negativa (CPN) como adjuvante no tratamento com matriz de regeneraçao dérmica (MRD) em crianças atendidas no serviço de Cirurgia Pediátrica do Hospital Infantil Joana de Gusmao (HIJG), no período de janeiro de 2009 a março de 2013.
MÉTODOSFoi desenvolvido um estudo retrospectivo, descritivo e transversal a partir de uma linha de pesquisa desenvolvida até 2010 com continuidade da casuística até 2013.
CasuísticaForam analisados um total de 58 pacientes submetidos a tratamento cirúrgico utilizando matriz de regeneraçao dérmica (MRD) associada ao curativo sob pressao negativa (CPN), no Hospital Infantil Joana de Gusmao (HIJG), no período compreendido entre janeiro de 2009 e março de 2013. Os prontuários foram selecionados a partir dos registros computadorizados de cirurgias do Centro Cirúrgico do HIJG e acessados por meio do Serviço de Arquivo Médico e Estatístico (SAME) do HIJG.
ProcedimentosOs dados foram coletados no Serviço de Arquivo Médico e Estatístico (SAME) do HIJG, baseados em um protocolo da linha de pesquisa prévia.
O perfil das crianças foi analisado de acordo com idade, sexo, procedência, indicaçao de uso da MRD, regiao corporal acometida, tempo de maturaçao e percentual de pega da MRD, complicaçoes pós-operatórias, número de trocas do curativo, resultado final e percentual de pega do enxerto de pele.
Em relaçao à idade, os pacientes foram distribuídos seguindo os critérios de faixa etária de Marcondes
46.
Quanto ao implante da MRD, a indicaçao de uso foi definida segundo a etiologia do ferimento. A regiao corporal acometida, de acordo com a localizaçao anatômica da lesao. Analisou-se o tempo de maturaçao de acordo com a coloraçao no leito da lesao a cada troca de curativo, que evolui de vermelho, num estágio mais precoce, até a fase madura, com coloraçao laranja-amarelada. Foram analisadas, ainda, as complicaçoes pós-operatórias e o percentual de pega por área de superfície da MRD.
O número de trocas do CPN foi baseado na quantidade de vezes em que o curativo foi manipulado tanto pela troca rotineira quanto pela necessidade de refazer o curativo após detecçao de defeitos.
O resultado final foi analisado segundo quatro desfechos possíveis: fechamento por contraçao ou segunda intençao, necessidade de fechamento por sutura, rotaçao de retalho ou enxerto de pele. Foi analisado o percentual de pega por área de superfície do enxerto de pele.
Após a coleta dos dados no protocolo pré-estabelecido, esses foram arquivados, compilados, catalogados e analisados utilizando-se o programa Microsoft Excel 2003, sendo feita a análise da frequência e tabulaçao cruzada das variáveis de interesse.
Este trabalho foi avaliado e aprovado pelo Comitê de Ética em Pesquisa em seres humanos do Hospital Infantil Joana de Gusmao, segundo protocolo número 011/2010.
RESULTADOSDas 54 crianças, 35 (64%) eram do sexo masculino e 19 (35%) do sexo feminino. A idade dos pacientes variou de 7 meses a 14 anos, sendo a média de 9,2 anos. A idade mais prevalente foi a prépúbere, de 10 a 15 anos, correspondendo a 42% do total.
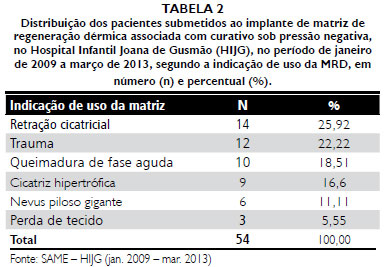
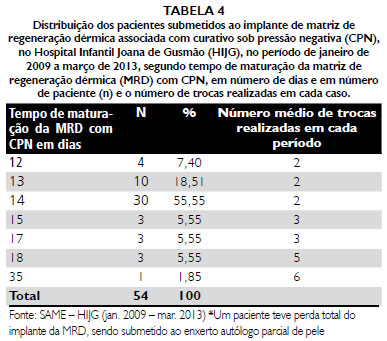
Obteve-se como desfecho final o enxerto de pele em 100% dos casos. A média de pega do autoenxerto foi de 93,62% (Tabelas 1 a 5).
DISCUSSAOO princípio de regeneraçao da derme quando se utiliza a MRD se inicia com a migraçao de macrófagos e degradaçao progressiva da matriz de colágeno bovino e seguido pelo seu preenchimento com colágeno e elastina autógenos sintetizados a partir da migraçao de fibroblastos; a condroitina 6-fosfato, outro componente da matriz, funciona como um molde para uma neovascularizaçao ordenada com formaçao de canais vasculares. Para tanto, a fixaçao e aderência da matriz ao leito da ferida é um requerimento absolutamente necessário para o sucesso desta neovascularizaçao
47.
Em condiçoes normais, a neoderme está neovascularizada geralmente após 21 dias, quando assume a coloraçao amarelo avermelhada e aderida ao leito
48. A correta imobilizaçao do paciente com curativos compressivos, elásticos, talas e imobilizaçao tem sido utilizada para evitar o deslocamento da MRD. Nesse sentido, os curativos de pressao negativa vêm sendo cada vez mais utilizados também para a fixaçao da MRD ao leito da ferida
47.
A grande vantagem, além da sua imobilizaçao, se deve ao regime de pressao negativa, que acelera o processo de neovascularizaçao associado à reduçao de edema, aspiraçao de líquidos, com consequente diminuiçao das taxas de infecçao, que aumenta a velocidade do fechamento da ferida e otimiza a pega do enxerto de pele pela maior vascularizaçao da matriz
49. O uso do CPN em combinaçao com MRD tem sido relatado ultimamente, e tem reduzido o tempo de revascularizaçao da matriz em aproximadamente 10 dias
50-52.
A terapia com CPN pode ser uma ferramenta eficaz para se atingir as propriedades de adesao desejadas em lesoes de localizaçao complicada e em pacientes potencialmente problemáticos. Comparados com adultos, lactentes e crianças sao um grupo de maior risco para a perda do implante de MRD, porque eles nao podem compreender e obedecer às instruçoes direcionadas à proteçao do implante. Portanto, pacientes pediátricos merecem uma indicaçao muito mais relevante para uso de CPN que adultos, especialmente quando superfícies irregulares e em movimento estao envolvidas
51-53.
Com o objetivo de avaliar os resultados da utilizaçao da MRD em associaçao ao CPN no tratamento de feridas de fase aguda ou sequelas no Hospital Infantil Joana de Gusmao, foram analisados os pacientes submetidos a este tratamento no período de janeiro de 2009 a março de 2013, totalizando 54 pacientes, dando continuidade à linha de pesquisa prévia.
Ao iniciar pela análise da idade dos pacientes estudados, viu-se que no estudo de Stiefel et al.
53, no qual foi utilizado o CPN para fixaçao da MRD em cirurgias reconstrutivas em 18 pacientes, a idade variou de 7 meses a 16,5 anos, com uma média de 7,6 anos, obtendo uma maior prevalência na faixa etária pré-púbere. Já Nery
54, em seu estudo sobre o uso do CPN em 21 pacientes internados no HIJG de janeiro a outubro de 2009, com uso de MRD em 52,38% dos casos, obteve uma média de idade de 7 anos, variando de 7 dias a 13 anos; ainda em outro estudo realizado nesse mesmo hospital, analisando a pega da matriz dérmica entre 2009 e 2010, a idade pré-púbere foi a mais prevalente (33,33%), seguida pelos escolares (27,78%) e a maioria das crianças era do sexo masculino (61,11%)
52. Essa tendência da linha de pesquisa do HIJG se manteve na presente análise, com as crianças em idade escolar (24,0%) e pré-púberes (33,3%) continuando sendo, atualmente, as mais atingidas.
Em relaçao à sua indicaçao clítica, na literatura pesquisada, o CPN vem sendo indicado para o tratamento de feridas crônicas, agudas, traumáticas, subagudas, deiscências, queimaduras de espessura parcial, úlceras diabéticas, úlceras de pressao, retalhos e enxertos
1. No HIJG, Nery
54 obteve como principais indicaçoes do CPN fratura exposta (23,81%) e ressecçao de cicatriz hipertrófica (23,81%). Por outro lado, a MRD tem sido utilizada com sucesso na reconstruçao de lesoes complicadas, incluindo feridas com leito pouco vascularizado, retraçoes cicatriciais por queimaduras, queloides, lesoes/queimaduras de espessura total
55. Na amostragem relatada por Manara
56, também no HIJG, as principais indicaçoes do uso da MRD foram uma combinaçao de retraçoes e hipertrofia da escara (40,08%) e retraçoes cicatriciais (30,36%).
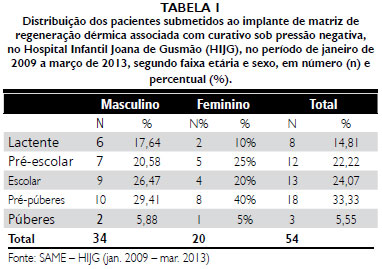
No presente trabalho, as indicaçoes para uso da matriz foram similares àquelas citadas na literatura e mantêm-se nos mesmos parâmetros da linha de pesquisa do Hospital Infantil Joana de Gusmao, com a reconstruçao de sequelas de queimaduras (25,92%), queimaduras de fase aguda (18,51%) e o trauma (22,22%) como as indicaçoes mais frequentes.
Quando analisado o resultado dessa terapia combinada, entre os trabalhos revisados, a média de pega por área de superfície de MRD implantada variou entre 95% e 98% com o uso do CPN como adjuvante
2,47,53,55,57. Os resultados de Stiefel et al.
53 mostraram pega total da matriz em 14 pacientes (77,78%) dos 18 pacientes. Quatro pacientes receberam implante duas vezes devido à perda parcial da MRD. A média de pega no total dos casos correspondeu a 84% após a primeira aplicaçao e 95% após a segunda aplicaçao nos quatro pacientes citados. Jeschke et al.
2, usando uma combinaçao de MRD, cola de fibrina e 4 dias de terapia contínua com CPN versus terapia com curativo convencional, alcançaram uma taxa de pega da MRD de 98% + 2, comparada com 78% + 8 no grupo controle (
p<0.003).
McEwan et al.
47, assim como Park et al.
55, utilizaram MRD em associaçao ao CPN e relataram uma taxa de conversao da matriz em neoderme em média de 98%. Na análise da linha de pesquisa do Hospital Infantil Joana de Gusmao, realizada por Goulart et al.
51, a pega total da MRD ocorreu em 15 (83,33%) dos 18 pacientes, valores muito próximos aos encontrados por Stiefel et al.
53.
Na análise realizada neste trabalho, totalizando os casos da linha de pesquisa de 2009 a 2013, o uso do CPN tem demonstrado uma tendência a melhorar ainda mais os índices de pega da MRD ao leito, chegando a índices de pega total de 83,33%.
Em relaçao ao tempo de maturaçao da MRD, Bovill et al.
57 mostraram em seu estudo de revisao que Molnart et al. conduziram um estudo laboratorial em que o CPN mostrou ter melhorado a vascularizaçao em 3 dias comparado com os controles. Mais tarde, conduziram estudos clínicos com uma série de oito pacientes, resultando em uma taxa média de 7-25 dias para a vascularizaçao da matriz com CPN. Quanto aos resultados obtidos por Jeschke et al.
2, o tempo de enxertia de pele foi reduzido em 60%, de cerca de 24 + 3 dias no grupo que recebeu tratamento convencional para cerca de 10 + 1 dia no grupo que recebeu o CPN (
p<0,002), com o benefício da reduçao no tempo de internaçao hospitalar. No HIJG, o tempo de maturaçao da MRD em estudos anteriores sem uso do CPN era, em média, de 21 dias
56.
O tempo de médio de maturaçao da MRD em estudos prévios realizados no HIJF foi de 15,88 dias, em uma faixa de 13 a 35 dias. A maioria dos pacientes teve maturaçao completa em 14 dias (52,94%). A reduçao no número de dias para maturaçao da MRD encontrada nesse estudo e em outros trabalhos que utilizaram a associaçao com CPN parece ser relacionada à capacidade deste curativo de melhorar o aporte sanguíneo no leito da lesao, além de diminuir o edema e o risco de infecçao, segundo dados da literatura
35-42. Essa tendência de maturaçao mais precoce da MRD associada à CPN ficou ainda mais evidente com a casuística atual desse trabalho que foi ampliada.
Pudemos observar que nesse estudo também a maioria dos pacientes apresentou uma maturaçao da MRD em torno do 14º dia, elevando o percentual para 55,55%, que se somados ao total de pacientes que foram considerados como maduros no 12º dia (7,40%) e no 13º dia (18,71%) mostra uma significativa reduçao no tempo de maturaçao da matriz, com reduçao dos dias de internaçao hospitalar, de custos e de aparecimento de comorbidades.
Por outro lado, em relaçao à troca dos curativos, Nery
54 obteve média de cinco trocas durante o tratamento, com uma faixa de 2 a 10 trocas realizadas. A literatura recomenda trocas a cada 2 a 3 dias, o que elimina o desconforto das trocas diárias tipicamente utilizadas no curativo convencional
58. A média de 3,06 procedimentos
51, em uma faixa de 1 a 5 trocas realizadas no estudo prévio, baixou, na casuística total, para 2,34 trocas, o que reflete uma curva de aprendizado em relaçao ao uso dessa associaçao terapêutica que permitiu menor troca de curativos, permanecendo mais tempo de uso contínuo.
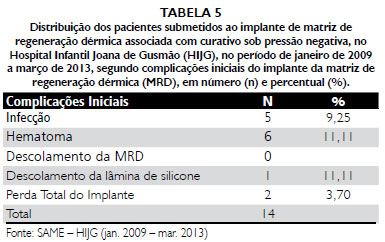
Finalmente, em relaçao às complicaçoes do uso dessa terapia combinada, no estudo de Stiefel et al.
53, a taxa de complicaçao foi de 33%, incluindo três casos infecçao (16,5%), dois casos de seroma (11%) e um de nao integraçao (5,5%), que levaram à perda parcial do implante em três pacientes. Estas complicaçoes foram relacionadas pelos autores aos já conhecidos problemas especificamente advindos do uso da MRD, e nao associadas ao uso do CPN, o qual age reduzindo a quantidade de secreçao na ferida através da sucçao contínua, diminuindo, dessa forma, o risco de seroma, hematoma e infecçao.
Segundo Manara
56, que usou MRD sem o CPN como adjuvante no tratamento, as complicaçoes iniciais mais comuns após o implante da MRD foram hematomas (26,79%) e infecçoes (17,86%), o que justifica a conclusao de Stiefel et al.
53. É importante evitar o uso do CPN na presença de infecçao invasiva maciça e sangramento ativo no local da ferida, contraindicaçoes desta terapia no tratamento de feridas agudas, evitando, dessa forma, complicaçoes
57.
No estudo prévio do HIJG realizado por Goulart et al.
51, dos 18 casos, oito sofreram complicaçoes, o que corresponde a 44,44% dos implantes, sendo a complicaçao mais comum o hematoma, com quatro casos, seguido de dois casos de infecçao e dois casos de perda total do implante. Essa tendência se manteve na compilaçao de todos os casos dessa mesma linha de pesquisa, agora com um total de seis casos de hematoma, cinco de casos infecçao, um caso de deslocamento da lâmina de silicone e os mesmos dois casos de perda total do estudo anterior que foram somados à presente casuística.
CONCLUSOES1. O curativo sob pressao negativa acelera a maturaçao da matriz de regeneraçao dérmica. O tempo médio de maturaçao da MRD com CPN mais frequente foi de 14 dias, com duas trocas de curativos.
2. A média de pega por área de superfície da MRD atingiu 83,33% para pegas totais e 12,95% para pegas parciais e as principais complicaçoes iniciais foram hematomas, infecçao e perda total do implante.
REFERENCIAS1. Baharestani M, Amjad I, Bookout K, Fleck T, Gabriel A, Kaufman D, et al. V.A.C. Therapy in the management of paediatric wounds: clinical review and experience. Int Wound J. 2009;6 Suppl 1:1-26.
2. Jeschke MG, Rose C, Angele P, Füchtmeier B, Nerlich MN, Bolder U. Development of new reconstructive techniques: use of Integra in combination with fibrin glue and negative-pressure therapy for reconstruction of acute and chronic wounds. Plast Reconstr Surg. 2004 Feb;113(2):525-30.
3. Caniano DA, Ruth B, Teich S. Wound management with vacuum-assisted closure: experience in 51 pediatric patients. J Pediatr Surg. 2005;40(1):128-32.
4. Gabriel A, Heinrich C, Shores J, Cho D, Baqai W, Moores D, et al. Outcomes of vacuum-assisted closure for the treatment of wounds in a paediatric population: case series of 58 patients. J Plast Reconstr Aesthet Surg. 2009;62(11):1428-36.
5. Janzekovic Z. The burn wound from the surgical point of view. J Trauma. 1975;15(1):42-62.
6. Edelberg JM, Tang L, Hattori K, Lyden D, Rafii S. Young adult bone marrow-derived endothelial precursor cells restore aging-impaired cardiac angiogenic function. Circ Res. 2002;90(10):E89-93.
7. Junqueira LC, Carneiro J. Histologia básica. 10a ed. Rio de Janeiro: Guanabara Koogan; 2004.
8. Böttcher-Haberzeth S, Biedermann T, Reichmann E. Tissue engineering of skin. Burns. 2010;36(4):450-60.
9. Jaksic T, Burke JF. The use of "artificial skin" for burns. Annu Rev Med. 1987;38:107-17.
10. Kumar P. Classification of skin substitutes. Burns. 2008;34(1):148-9.
11. Balasubramani M, Kumar TR, Babu M. Skin substitutes: a review. Burns. 2001;27(5):534-44.
12. Bar-Meir E, Mendes D, Winkler E. Skin substitutes. Isr Med Assoc J. 2006;8(3):188-91.
13. Yannas IV, Burke JF. Design of an artificial skin. I. Basic design principles. J Biomed Mater Res. 1980;14(1):65-81.
14. Jones I, Currie L, Martin R. A guide to biological skin substitutes. Br J Plast Surg. 2002;55(3):185-93.
15. Heimbach DM, Warden GD, Luterman A, Jordan MH, Ozobia N, Ryan CM, et al. Multicenter postapproval clinical trial of Integra dermal regeneration template for burn treatment. J Burn Care Rehabil. 2003;24(1):42-8.
16. Burke IF. Observations on the development and clinical use of artificial skin--an attempt to employ regeneration rather than scar formation in wound healing. Jpn J Surg. 1987;17(6):431-8.
17. Besner GE, Klamar JE. Integra Artificial Skin as a useful adjunct in the treatment of purpura fulminans. J Burn Care Rehabil 1998;19(4):324-9.
18. Cotran RS, Kumar V, Robbins SL, Schoen F. Inflamaçao e Reparaçao. Patologia Estrutural e Funcional. 5ª ed. Rio de Janeiro: Guanabara Koogan; 1996.
19. Orgill DP, Butler C, Regan JF, Barlow MS, Yannas IV, Compton CC. Vascularized collagen-glycosaminoglycan matrix provides a dermal substrate and improves take of cultured epithelial autografts. Plast Reconstr Surg. 1998;102(2):423-9.
20. Orgill DP, Butler CE, Regan JF. Behavior of Collagen-GAC matrices as Dermal Replacement in Rodent and Porcine Models. Wounds1996;8(5):151-7.
21. Orgill DP, Strauss II FH, Lee RC. The use of Collagen-GAC Membranes in Reconstrutive Surgery. Ann NY Acad Scien. 1999;888:233-48.
22. Dantzer E, Queruel P, Salinier L, Palmier B, Quinot JF. Integra, a new surgical alternative for the treatment of massive burns. Clinical evaluation of acute and reconstructive surgery: 39 cases. Ann Chirur Plast Esthet. 2001;46(3):173-89.
23. Branski LK, Herndon DN, Pereira C, Mlcak RP, Celis MM, Lee JO, et al. Longitudinal assessment of Integra in primary burn management: a randomized pediatric clinical trial. Crit Care Med. 2007;35(11):2615-23.
24. Salvato RA. Uso de matriz de regeneraçao dérmica no tratamento cirúrgico de crianças com queimaduras do Hospital Infantil Joana de Gusmao - cinco anos de experiência [Monografia]. Florianópolis: Universidade Federal de Santa Catarina. Curso de Medicina; 2007. p.48.
25. Perdomo HAR. Estudo da utilizaçao da matriz de regeneraçao dérmica em crianças com sequelas de queimaduras - estudo epidemiológico em um centro de referência no sul do Brasil [Trabalho de conclusao de curso]. Florianópolis: Universidade Federal de Santa Catarina; 2004.
26. Tomita LA. Uso da matriz de regeneraçao dérmica no tratamento cirúrgico de queimaduras em crianças [Monografia]. Florianópolis: Universidade Federal de Santa Catarina. Curso de Medicina; 2005. p.49.
27. Figueiredo GKB. Uso de matriz de regeneraçao dérmica no tratamento cirúrgico do nevus melanocítico congênito gigante: relato de 3 casos. Florianópolis: Universidade Federal de Santa Catarina. Curso de Medicina; 2007.
28. Michaeli D, McPherson M. Immunologic study of artificial skin used in the treatment of thermal injuries. J Burn Care Rehabil. 1990;11(1):21-6.
29. Dantzer E, Braye FM. Reconstructive surgery using an artificial dermis (Integra): results with 39 grafts. Br J Plast Surg. 2001;54(8):659-64.
30. Groos N, Guillot M, Zilliox R, Braye FM. Use of an artificial dermis (Integra) for the reconstruction of extensive burn scars in children. About 22 grafts. Eur J Pediatr Surg. 2005;15(3):187-92.
31. Bütter A, Emran M, Al-Jazaeri A, Ouimet A. Vacuum-assisted closure for wound management in the pediatric population. J Pediatr Surg. 2006;41(5):940-2.
32. Mooney JF 3rd, Argenta LC, Marks MW, Morykwas MJ, DeFranzo AJ. Treatment of soft tissue defects in pediatric patients using the V.A.C. system. Clin Orthop Relat Res. 2000;(376):26-31.
33. Nugent N, Lannon D, O'Donnell M. Vacuum-assisted closure - a management option for the burns patient with exposed bone. Burns. 2005;31(3):390-3.
34. Schintler M, Marschitz I, Trop M. The use of topical negative pressure in a paediatric patient with extensive burns. Burns. 2005;31(8):1050-3.
35. Argenta LC, Morykwas MJ. Vacuum-assisted closure: a new method for wound control and treatment: clinical experience. Ann Plast Surg. 1997;38(6):563-76.
36. Morykwas MJ, Argenta LC, Shelton-Brown EI, McGuirt W. Vacuum-assisted closure: a new method for wound control and treatment: animal studies and basic foundation. Ann Plast Surg. 1997;38(6):553-62.
37. Isago T, Nozaki M, Kikuchi Y, Honda T, Nakazawa H. Effects of different negative pressures on reduction of wounds in negative pressure dressings. J Dermatol. 2003;30(8):596-601.
38. Hunt TK. The physiology of wound healing. Ann Emerg Med. 1988;17(12):1265- 73.
39. Urschel JD, Scott PG, Williams HT. The effect of mechanical stress on soft and hard tissue repair; a review. Br J Plast Surg. 1988;41(2):182-6.
40. Clare MP, Fitzgibbons TC, McMullen ST, Stice RC, Hayes DF, Henkel L. Experience with the vacuum assisted closure negative pressure technique in the treatment of nonhealing diabetic and dysvascular wounds. Foot Ankle Int. 2002;23(10):896-901.
41. Gregor S, Maegele M, Sauerland S, Krahn JF, Peinemann F, Lange S. Negative pressure wound therapy: a vacuum of evidence? Arch Surg. 2008;143(2):189-96.
42. Ford HR, Hoffman RA, Wing EJ, Magee DM, McIntyre L, Simmons RL. Characterization of wound cytokines in the sponge matrix model. Arch Surg. 1989;124(12):1422-8.
43. Falanga V, Isaacs C, Paquette D, Downing G, Kouttab N, Butmarc J, et al. Wounding of bioengineered skin: cellular and molecular aspects after injury. J Invest Dermatol. 2002;119(3):653-60.
44. Müllner T, Mrkonjic L, Kwasny O, Vécsei V. The use of negative pressure to promote the healing of tissue defects: a clinical trial using the vacuum sealing technique. Br J Plast Surg. 1997;50(3):194-9.
45. Potter MJ, Banwell P, Baldwin C, Clayton E, Irvine L, Linge C, et al. In vitro optimisation of topical negative pressure regimens for angiogenesis into synthetic dermal replacements. Burns. 2008;34(2):164-74.
46. Marcondes E, Vaz FAC, Ramos JLA, Okay Y. Pediatria Básica. 9a ed. Sao Paulo: Sarvier; 2003.
47. McEwan W, Brown TL, Mills SM, Muller MJ. Suction dressings to secure a dermal substitute. Burns. 2004;30(3):259-61.
48. Pollard RL, Kennedy PJ, Maitz PK. The use of artificial dermis (Integra) and topical negative pressure to achieve limb salvage following soft-tissue loss caused by meningococcal septicaemia. J Plast Reconstr Aesthet Surg. 2008;61(3):319-22.
49. Pu LL. An alternative approach for soft-tissue coverage of a complex wound in the foot and ankle with vacuum-assisted closure over artificial dermis and subsequent skin graft. J Plast Reconstr Aesthet Surg. 2009;62(12):e682-4.
50. Ilussey AJ, Potter-Beirne S, Kelly JL. The use of artificial dermis in conjunction with negative pressure therapy-a technical tip. Eur J Plast Surg. 2007;30(3):137-9.
51. Goulart BC, Valentim L, Pereima MJL, Souza JA, Araújo EJ, Capella MR, et al. Análise do tempo de maturaçao dos implantes de matriz de regeneraçao dérmica utilizando curativos sob pressao negativa. Rev Bras Queimaduras. 2010;9(4):124-9.
52. Wunderlich BL, Marcolla B, Souza JA, Araujo EJ, Feijó R, Pereima MJL. Curativo com pressao negativa e matriz de regeneraçao dérmica: uma nova opçao de tratamento para feridas extensas. Rev Bras Queimaduras. 2011;10(3):78-84.
53. Stiefel D, Schiestl CM, Meuli M. The positive effect of negative pressure: vacuumassisted fixation of Integra artificial skin for reconstructive surgery. J Pediatr Surg. 2009;44(3):575-80.
54. Nery LFC. Análise da utilizaçao dos curativos sob pressao negativa no Hospital Infantil Joana de Gusmao no ano de 2009 [Monografia]. Florianópolis: Universidade Federal de Santa Catarina, Curso de Medicina; 2009.
55. Park CA, Defranzo AJ, Marks MW, Molnar JA. Outpatient reconstruction using integra* and subatmospheric pressure. Ann Plast Surg. 2009;62(2):164-9.
56. Manara LM. Uso da matriz de regeneraçao dérmica no tratamento cirúrgico de crianças vítimas de queimaduras do Hospital Infantil Joana de Gusmao - Seis anos de experiência. [Monografia]. Florianópolis: Universidade Federal de Santa Catarina, Curso de Medicina; 2009.
57. Bovill E, Banwell PE, Teot L, Eriksson E, Song C, Mahoney J, et al. Topical negative pressure wound therapy: a review of its role and guidelines for its use in the management of acute wounds. Int Wound J. 2008;5(4):511-29.
58. Orgill DP, Manders EK, Sumpio BE, Lee RC, Attinger CE, Gurtner GC, et al. The mechanisms of action of vacuum assisted closure: more to learn. Surgery. 2009;146(1):40-51.
1. Cirurgiao Pediatra da Unidade de Queimados do Hospital Infantil Joana de Gusmao e Departamento de Pediatria da Universidade Federal de Santa Catarina, Florianópolis, SC, Brasil
2. Médico Residente em Dermatologia do Hospital Universitário da Universidade Federal de Santa Catarina, Florianópolis SC, Brasil
3. Médico da Emergência do Pronto Atendimento da Prefeitura Municipal de Biguaçu. Biguaçu, SC, Brasil
Correspondência:
Maurício José Lopes Pereima
R. Rui Barbosa, 152 - Agronômica
Florianópolis, SC, Brasil - CEP: 88025-300
E-mail:
mauricio.pereima@hotmail.comArtigo recebido: 17/6/2013
Artigo aceito: 15/8/2013
Trabalho realizado na Unidade de Tratamento de Queimados do Hospital Infantil Joana de Gusmao e na Universidade Federal de Santa Catarina. Florianópolis, SC, Brasil.