RESUMO
INTRODUÇAO: As espécies reativas de oxigênio (EROs) sao produzidas durante o metabolismo normal das células, tendo funçoes fisiológicas, como a sinalizaçao celular. Porém, em uma situaçao que leve o organismo à produçao exagerada de EROs, temos o chamado estresse oxidativo, que tem açao deletéria às células, podendo levar a apoptose ou senescência celular. A vitamina C é um dos principais a gentes antioxidantes do organismo, atuando em todas as formas de estresse oxidativo.
MÉTODO: Isolamento e cultivo de fibroblastos humanos dérmico em seis grupos: controle, Vitamina C +, Vitamina C -, H2O2, Vitamina C + H2O2, Vitamina C -H2O2. Os fibroblastos foram submetidos ao estresse oxidativo pela suplementaçao de H2O2 ao meio de cultura por 2 horas. Foram avaliadas proliferaçao pelo MTT, senescência celular pela marcaçao da enzima beta-galoctosidase, apoptose celular e liberaçao de radicais livres por citometria de fluxo.
RESULTADOS: O peróxido de hidrogênio aumentou significantemente a senescência celular e a apoptose nos fibroblastos, enquanto a vitamina C diminuiu significantemente a induçao a senescência celular somente no estado intracelular.
CONCLUSOES: O ácido ascórbico nao protegeu os fibroblastos humanos dérmicos cultivados contra o estresse oxidativo induzido pelo H2O2. O ácido ascórbico intracelular levou à diminuiçao da induçao à senescência celular.
Palavras-chave:
Ácido ascórbico. Estresse oxidativo. Apoptose. Senescência celular. Fibroblastos.
ABSTRACT
INTRODUCTION: Reactive oxygen species (ROS) are produced during normal metabolism of cells, with physiological functions such as cell signaling. But in a situation that causes the body to ROS overproduction, we have the so-called oxidative stress, which has deleterious effects on cells, leading to apoptosis or cellular senescence. Vitamin C is one of the main antioxidants in the body, working in all forms of oxidative stress.
METHODS: Isolation and culture of human dermal fibroblasts in six groups: control, + Vitamin C, -Vitamin C, H2O2, H2O2 + Vitamin C, H2O2 - Vitamin C. The fibroblasts were subjected to oxidative stress by supplements H2O2 to the culture medium for 2 hours. Were evaluated by MTT proliferation assay, cellular senescence by marking the enzyme beta-galactosidade, apoptosis and release of free radicals by flow cytometry.
RESULTS: Hydrogen peroxide significantly increased cellular senescence and apoptosis in fibroblasts, while vitamin C decreased significantly the induction of cellular senescence, just in the intracellular state.
CONCLUSIONS: Ascorbic Acid did not protect cultured human dermal fibroblasts against oxidative stress induced by H2O2. Ascorbic acid has led to decreased intracellular induction of cellular senescence.
Keywords:
Ascorbic acid. Oxidative stress. Apoptosis. Cell aging. Fibroblasts.
Dentre todos os constituintes celulares, o DNA nuclear é considerado o mais importante, exercendo controle sobre as demais estruturas e organelas. Logo, qualquer dano em sua estrutura, em uma única fita de DNA ou na dupla fita, é prontamente reconhecido pela célula e desencadeia uma resposta celular conhecida como Resposta ao DNA-Danificado (RDD)1. O RDD teria a funçao principal de impedir que um DNA danificado seja transmitido a células-filhas, pela interrupçao da duplicaçao celular, permitindo que os esforços se concentrem no reparo do DNA danificado, visando manter a integridade genômica.
Dependendo da intensidade da lesao, o dano ao DNA pode ser reparado, e a célula entra logo em um novo ciclo celular. Porém, se o dano for mais intenso, pode ser desencadeada a apoptose, definida como um modelo de morte celular utilizada por organismos pluricelulares em uma diversidade de situaçoes, cuja funçao é a de remover células danificadas de uma maneira irreversível2. Ainda, além da apoptose, a RDD pode levar a célula a um estado irreversível de parada de proliferaçao celular, conhecido como senescência celular, no qual as células nao respondem ao estímulo de crescimento, e demonstram alteraçoes características em suas propriedades citológicas e bioquímicas e em seu perfil de expressao genética3,4. Nao se conhece o fator determinante para que a célula sofra apoptose ou senescência celular, mas esses fatores podem estar relacionados ao tipo e à intensidade da agressao e tipo celular1,5,6.
Um dos principais agentes causadores de danos ao DNA sao as espécies reativas de oxigênio (EROs), cuja produçao ocorre, principalmente, no interior das mitocôndrias. As EROs estao envolvidas em processos celulares normais, como sinalizaçao celular e a proliferaçao; porém, quando em excesso, as EROs causam danos celulares que sao relacionados a numerosas doenças, como aterosclerose, doenças neurodegenerativas, inflamatórias, diabetes, câncer e envelhecimento7. O dano provocado pelas EROs ao DNA estaria também relacionado com o processo de envelhecimento e com a formaçao de neoplasias8. O acúmulo de DNA danificado pelas EROs é uma causa de senescência e de apoptose9.
A fim de diminuir as açoes prejudiciais das EROs, o organismo possui mecanismos intrínsecos para a remoçao das EROs, como enzimas removedoras de EROs, as superóxido dismutase, catalase, peroxidase, entre outras, proteínas que sequestram íons metálicos de transiçao, como ferritina, transferrina, peptídeos de baixo peso molecular e cofatores (glutationa, NADPH, tireodoxina), e agentes sequestradores de radicais livres que sao adquiridos na dieta (tocoferol e vitamina C, entre outros)10,11.
A funçao da vitamina C como protetora contra o dano causado ao DNA pelo estresse oxidativo é controversa. Muitos trabalhos apontam para um efeito protetor da vitamina C em leucócitos12-14, enquanto outros sugerem nao haver efeito protetor, ou mesmo um efeito pró-oxidante15-17.
Assim, sabendo-se que a senescência celular e a apoptose sao fenômenos relacionados ao estresse oxidativo, e pela açao controversa da vitamina C como antioxidante, foi levantada a hipótese de que a vitamina C apresentaria açao
in vitro em fibroblastos humanos dérmicos submetidos ao estresse oxidativo induzido pelo peróxido de hidrogênio (H
2O
2).
MÉTODO
Cultivo de FibroblastosFragmentos de pele descartados de atos operatórios foram utilizados. Os fragmentos de pele foram processados em ambiente estéril, numa capela de fluxo laminar, com pinça e tesoura, havendo separaçao do tecido subcutâneo da pele. Cerca de 10 fragmentos de pele, de aproximadamente 5 mm
2 cada, foram dispostos em espaços equidistantes em uma placa de Petri de 100 mm
2, cuja superfície interna foi marcada com ranhuras produzidas por uma lâmina de bisturi. As placas com os fragmentos foram mantidas abertas dentro desse ambiente por cerca de 40 minutos, para que os mesmos secassem e se fixassem na placa. Após esse período, acrescentou-se 10 ml de meio próprio para cultivo de fibroblastos, constituído de DMEM, 10% de soro fetal bovino (SFB) (Gibco - Invitrogen Corporation, Carlsbad, CA, EUA) e 1% de soluçao penicilina/estreptomicina (100U de penicillina e 100
µg de estreptomicina por ml) (Gibco - Invitrogen Corporation, Carlsbad, CA, EUA).
As placas foram mantidas em incubadora a 37ºC, umidificadas numa mistura gasosa de dióxido de carbono a 5%, sendo o meio de cultura trocado a cada dois dias. Entre o 5º e 7º dia, foi observada migraçao de fibroblastos sobre a placa, atingindo a confluência de 80% por volta do 15º dia. Culturas secundárias foram realizadas por meio da tripsinizaçao, sendo as células distribuídas em garrafas de 75 cm
2. Ao atingir a quarta passagem, as células foram utilizadas nos procedimentos ou congeladas em nitrogênio líquido para utilizaçao posterior. Apenas células entre a quarta e a nona passagem foram utilizadas nos experimentos.
Suplementaçao com o Acido AscórbicoFoi utilizado o Ascorbato de Sódio (L-ascorbic acid, sodium salt, Sigma-Aldrich, St Louis, Missouri, EUA) nos experimentos. As soluçoes foram preparadas imediatamente antes do uso, e diluídas no meio próprio de cultivo para fibroblastos, na concentraçao de 100
µM. Foram incubadas 6 horas antes da exposiçao ao H
2O
2, e por duas horas junto com o H
2O
2, sendo o meio trocado em seguida. Foi tomado o cuidado de manter o pH próximo a 7,4.
Divisao dos GruposOs fibroblastos cultivados foram divididos em seis grupos:
Controle: utilizou-se apenas o meio para fibroblastos;Vitamina C (-): as células foram expostas à concentraçao de 100 µM de ácido ascórbico por seis horas;Vitamina C (+): as células foram expostas à concentraçao de 100 µM de ácido ascórbico por seis horas, sendo o meio trocado por um novo contendo a mesma concentraçao de ácido ascórbico por mais duas horas;H2O2: as células foram expostas à concentraçao de 150 µM de H2O2 por duas horas.Vitamina C (-) e H2O2: as células foram expostas inicialmente à concentraçao de 100 µM de ácido ascórbico por seis horas, e posteriormente a 150 µm de H2O2;Vitamina C (+) e H2O2: as células foram expostas inicialmente à concentraçao de 100 µM de ácido ascórbico por seis horas, sendo o meio trocado por outro contendo ácido ascórbico (100 µM) e H2O2 (150 µm).Proliferaçao CelularA proliferaçao celular foi avaliada utilizando o MTT, previamente descrito por Mosmann18. As 2,5 células de cada grupo foram distribuídas em triplicata em placas de 96 poços. Foram distribuídas 2,5 x 10
3 células por poço contendo 100
µl de meio para fibroblastos e mantidas em incubadora úmida a 37ºC, com CO
2 a 5%, por 24 horas. As células foram expostas ao ácido ascórbico e/ou H
2O
2, conforme descrito anteriormente, e 24 horas depois, 10
µl do reagente MTT (0,5 mg/ml) foi adicionado aos poços de cada grupo incubado por 4 horas a 37ºC. A seguir, o conteúdo foi aspirado e 100 L da soluçao 0,04 M de HCl em isopropanol foram adicionados e mantidos por 15 minutos em temperatura ambiente.
A leitura da espectrofotometria foi feita utilizando o leitor de microplacas para teste de ELISA (Anthos 2010, Anthos Labtec Instruments
®, Wals/Salzburg, Austria) calibrado em 590 nm. O mesmo procedimento foi realizado diariamente por sete dias, formando uma curva de proliferaçao celular.
Avaliaçao da Senescência CelularPara a avaliaçao da senescência foi realizada a marcaçao da enzima beta-galactosidase (
Senescence Detection Kit, Cat -JM-K320-250, MBL
® Int Corp., MA, EUA). As células foram colocadas em garrafas de 25 cm
2 e, quando atingiram uma confluência de 80%, foram expostas ao ácido ascórbico e/ou H
2O
2. Vinte e quatro horas após, as células foram distribuídas em placas de 24 poços, em concentraçao de 5000 células por poço. A marcaçao da enzima beta-galactosidase foi realizada 48 horas após, sendo contadas 300 células por poço e estabelecendo-se a porcentagem de células senescentes19.
Avaliaçao da ApoptosePara a avaliaçao da apoptose das células, foram utilizados o iodeto de propídeo (PI) e a anexina V (AV) (Sigma-Aldrich, St Louis, Missouri, EUA) no citômetro de fluxo FACSClibur (Becton Dickinson Immunocytometry Systems, CA, EUA)20,21.
A avaliaçao ocorreu 24 horas depois da exposiçao ao ácido ascórbico e/ou H
2O
2. As células foram distribuídas em quatro tubos, contendo 250.000 células/ml em 1 ml do tampao para anexina (kit de anexina V -BD Pharmingen, San Jose/CA/EUA), conforme orientaçao do fabricante.
No primeiro tubo, permaneceram somente as células, sem marcaçao; no segundo tubo, as células foram marcadas com 5
µl de anexina V; no terceiro tubo, as células foram marcadas com 10
µl de PI; e no quarto tubo, as células foram marcadas com 5
µl de anexina V e 10
µl de PI. Após a marcaçao, as células foram incubadas por 20 minutos em temperatura ambiente, protegidas da luz. Em seguida, foram adicionados 300
µl do tampao para anexina e levados para a leitura no citômetro de fluxo. A análise dos dados foi feita no próprio aparelho utilizando o programa CELL QUEST.
Produçao de Radicais LivresPara a detecçao da produçao de radicais livres, foi utilizado o diacetato diclorofluoresceína (DCFH-DA) (Sigma-Aldrich, St Louis, EUA).
Os fibroblastos foram semeados em garrafas de 75 cm
2, nos grupos descritos anteriormente. Após a aplicaçao da vitamina C ou do H
2O
2, ou de ambos, as células foram suspensas em 800
µl de PBS. Para utilizar o DCFH-DA, uma soluçao estoque de 25 mM foi mantida congelada a -20ºC, protegida da luz, utilizando-se como solvente álcool absoluto (etanol). No momento de ser utilizada, essa soluçao foi descongelada, e 25
µl foram diluídos em 2,05 ml de PBS, criando-se uma soluçao final de DCFH-DA. No momento do uso, 200
µl dessa soluçao final foi adicionada a cada grupo (volume final de 1000
µl), deixado em repouso protegido da luz e a uma temperatura de 37ºC por 30 minutos, e levadas para a leitura no citômetro de fluxo FACs Calibur. A leitura dos dados foi realizada com o uso do programa CELL QUEST.
Método EstatísticoA análise estatística dos resultados foi determinada usando-se o teste de ANOVA para variáveis ou para comparaçoes em três ou mais grupos, aplicando-se o teste de Tukey para comparaçao das médias. A significância estatística foi dada para p < 0,05.
Nos gráficos, quando houve diferença significante entre os grupos, foi assinalado com um asterisco (*).
RESULTADOS
Proliferaçao CelularA curva de proliferaçao celular obtida pode ser observada na Figura 1, observando-se a formaçao de dois padroes de curvas de crescimento, um formado pelos grupos em que houve a exposiçao ao H
2O
2, e outro em que nao houve essa exposiçao.
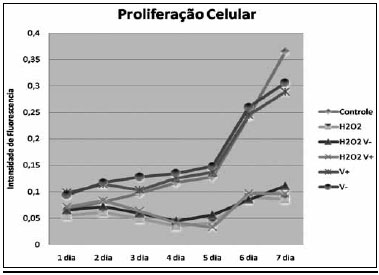
Figura 1 - Variaçao da intensidade de fluorescência pelo MTT no decorrer do tempo por grupo.
A Figura 2 demonstra a média da percentagem de populaçao celular senescente nos diferentes grupos.
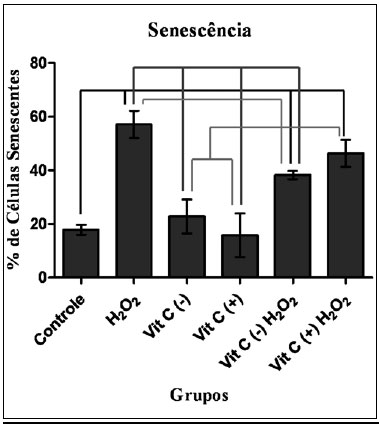
Figura 2 - Médias da percentagem de fibroblastos senescentes por grupo, assinalandose a diferença estatística entre os mesmos.
O grupo Controle apresentou diferença estatística com relaçao a todos os grupos, exceto os grupos Vitamina C (+) e Vitamina C (-).
O grupo H
2O
2 somente nao apresentou diferença estatística com o grupo Vitamina C (+) H
2O
2.
Os grupos Vitamina C (+) e Vitamina C (-) tiveram comportamento semelhante, com diferenças estatísticas com os grupos Controle, Vitamina C (+) H
2O
2 e Vitamina C (-) H
2O
2. Nao houve diferença estatística entre os dois grupos.
Os grupos Vitamina C (+) H
2O
2 e Vitamina C (-) H
2O
2 nao apresentaram diferença estatística entre si; porém, o primeiro nao teve diferença estatística com o grupo H
2O
2, enquanto o grupo Vitamina C (-) H
2O
2 apresentou diferença.
ApoptoseNa Figura 3, observa-se a média do percentual de células positivas para anexina e negativas para o iodeto de propídeo em cada um dos grupos estudados. Houve diferença significante somente entre o grupo Controle e os demais grupos.
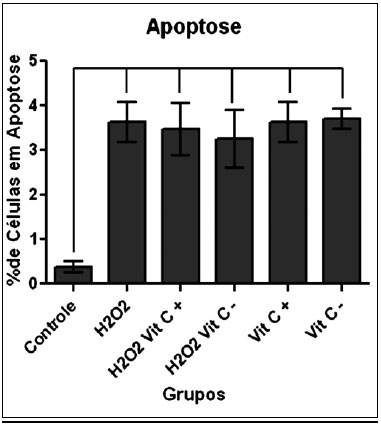
Figura 3 - Média do percentual de células positivas para Anexina e negativas para PI, por grupo, havendo diferença estatística somente entre o grupo controle e os demais grupos.
Na Figura 4, observam-se os valores da intensidade média de fluorescência obtidos na citometria de fluxo, nos diferentes grupos. Só houve diferença estatística entre o grupo controle e os demais grupos.
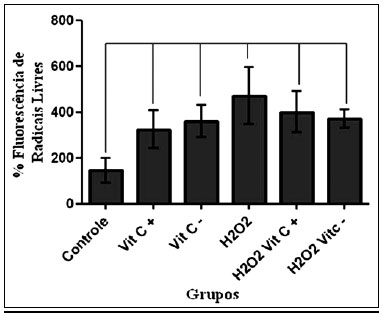
Figura 4 - Média dos valores da intensidade de fluorescência, unidades arbitrárias, por grupo.
As células do corpo humano estao frequentemente expostas às açoes das EROs, que sao provenientes de várias origens, tanto externas como internas, sendo a última oriunda principalmente do metabolismo do organismo. Assim, a produçao de EROs e sua consequente reaçao com as várias moléculas do organismo, como proteínas, lipídios e o DNA, ocorre de uma maneira inevitável nos organismos aeróbios. Em baixas concentraçoes, as EROs desempenham importantes funçoes fisiológicas, como a sinalizaçao celular22, enquanto que grandes concentraçoes de EROs apresentam efeito danoso às células, levando ao denominado estresse oxidativo, danificando estruturas moleculares, como proteínas, lipídios e DNA23,24, e que está relacionado com o desenvolvimento de várias doenças, como aterosclerose, doenças cardiovasculares e doenças degenerativas7,8, além do envelhecimento23.
A vitamina C (ácido ascórbico) é um micronutriente solúvel em água, necessário para várias funçoes biológicas. Atua como cofator em reaçoes enzimáticas, como na síntese de colágeno25 , e é um importante antioxidante no plasma humano, eliminando radicais livres e protegendo contra a peroxidaçao lipídica26. Ele é amplamente distribuído em todos os tecidos do corpo, e recicla outros antioxidantes, como a vitamina E e a glutationa27. Ascorbato, a forma predominante da vitamina C no pH fisiológico, é um eficiente doador de elétrons em muitas reaçoes biológicas, capazes de substituir moléculas altamente reativas e danosas, pelo radical livre ascorbato (RLA)28. O ascorbato (A) rapidamente passa por duas consecutivas reaçoes reversíveis de perda de elétrons, gerando inicialmente o RLA, e após nova perda de elétron, o dehidroascorbato (DHA). O RLA é um radical livre pouco reativo, com potencial de reduçao baixo em relaçao com outros radicais livres, o que torna o ascorbato um eficiente doador de elétrons, neutralizando a açao de radicais livres de maior reatividade por um de menor intensidade10.
Porém, essa funçao protetora da vitamina C contra o estresse oxidativo, anulando os efeitos deletérios dos radicais livres, é ainda um assunto muito controverso na literatura. De um lado, há trabalhos que demonstram um efeito protetor da suplementaçao da vitamina C13,29, e que sua ausência levaria a um aumento do estresse oxidativo30. De outro lado, há trabalhos que sugerem um efeito pró-oxidante da vitamina C, levando a anos no DNA nuclear9,10,28,31.
O mecanismo de dano ao DNA induzido pela vitamina C e pelo H
2O
2 provavelmente envolve a reaçao dos íons Fe
2+ ou Cu
+ com o H
2O
232, levando a formaçao de radicais hidroxilas, que parecem estar relacionados diretamente com o mecanismo de dano ao DNA.
Utilizamos a dosagem de 100
µM, pois é a que mais se aproxima da concentraçao fisiológica do plasma sanguíneo de 80
µM33, e o tempo de exposiçao das células à vitamina C foi de seis horas, pois, após esse período, as células expostas à concentraçao de 100
µM de vitamina C atingem sua concentraçao máxima28,30. Com essas informaçoes foi construído um modelo de estudo para avaliar a açao da vitamina C quando em sua concentraçao intracelular máxima e em sua concentraçao extracelular fisiológica.
Os experimentos foram realizados quando os fibroblastos atingiram confluência de 80%, facilmente observada pela existência de poucos espaços nao ocupados pelos fibroblastos, evitando-se o estado de pós-confluência para que nao ocorresse uma marcaçao falso-positiva para a enzima beta-galactosidase, identificadora de células senescentes. Apesar dessa enzima ser utilizada como marcador da senescência celular, ela se torna presente, também, em cultura de células pós-confluentes, ainda nao senescentes19,34-36. Ainda, cultivos celulares com baixa confluência também apresentam número aumentado de células marcadas com a enzima beta-galactosidase37.
A coloraçao da enzima beta-galactosidase foi utilizada como forma de identificaçao de células senescentes, com estudos prévios, confirmando essa metodologia19,35,38,39. O grupo exposto ao H
2O
2, mas que apresentava a vitamina C somente intracelular, teve diferença estatística quando comparado ao grupo H
2O
2, demonstrando possível efeito protetor contra o estresse oxidativo da vitamina C em sua forma intracelular, evitando a formaçao de células senescentes. Aumento do estresse oxidativo já havia sido observado em cultivos celulares privados do ácido ascórbico30.
No estudo da apoptose, mesmo nos grupos em que foi utilizado somente o ácido ascórbico, houve induçao à formaçao da apoptose, o que pode ser explicado pela formaçao de H
2O
2 pela auto-oxidaçao do ácido ascórbico
in vitro, levando a estresse oxidativo28,40, e consequente lesoes no DNA nuclear das células31 . O uso de formas mais estáveis de ácido ascórbico, que nao se auto-oxidam no meio de cultura celular, permite o uso de concentraçoes maiores de ácido ascórbico, além de se adequar melhor ao estudo de culturas celulares com baixa concentraçao de células28,39.
Nao está claro o motivo pelo qual algumas células podem se recuperar da agressao pelo estresse oxidativo e entrar novamente no ciclo celular, enquanto outras nao recuperam mais a capacidade proliferativa, entrando num estado de senescência celular definitivo, e por último, células que sofrem apoptose. Uma possibilidade pode ser a heterogeneidade do dano causado no DNA pela exposiçao ao H
2O
2. Um fator determinante conhecido é o tipo celular, sabendo-se que fibroblastos tendem a desenvolver mais o processo de senescência celular, enquanto leucócitos tendem a apresentar apoptose6. A natureza e a intensidade do dano também parecem ser importantes5,41; porém, a maioria das células é capaz de ambos.
O dano causado ao DNA pelo estresse oxidativo muda de intensidade dependendo do tipo celular. As células Jurkat parecem ser seis vezes mais sensíveis do que células HL-60 ao dano ao DNA provocado pela associaçao de H
2O
2 e ascorbato. O motivo para tal diferença de resposta entre dois tipos celulares parece ser a concentraçao intracelular de mecanismos antioxidantes9, como a glutationa, cuja concentraçao intracelular é menor daquela encontrada em células HL-6042. Células cancerosas parecem ser mais sensíveis aos efeitos tóxicos do H
2O
2 do que células normais, possibilitando potencial tratamento para o câncer o uso de vitamina C43 .
Os resultados obtidos neste estudo abrem perspectivas para novos projetos relacionados ao estresse oxidativo e antioxidantes.
CONCLUSAOA vitamina C nao protegeu os fibroblastos humanos dérmicos cultivados contra o estresse oxidativo induzido pelo H
2O
2. A vitamina C intracelular levou à diminuiçao da induçao à senescência celular.
REFERENCIAS1. d'Adda di Fagagna F. Living on a break: cellular senescence as a DNA-damage response. Nat Rev Cancer. 2008;8(7):512-22.
2. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26(4):239-57.
3. Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961;25:585-621.
4. Ishikawa F. Cellular senescence as a stress response. Cornea. 2006;25(10 Suppl 1):S3-S6.
5. Rebbaa A, Zheng X, Chou PM, Mirkin BL. Caspase inhibition switches doxorubicin-induced apoptosis to senescence. Oncogene. 2003;22(18):2805-11.
6. Campisi J, d'Adda di Fagagna F. Cellular senescence: when bad things happen to good cells. Nat Rev Mol Cell Biol. 2007;8(9):729-41.
7. Evans MD, Dizdaroglu M, Cooke MS. Oxidative DNA damageand disease: induction, repair and significance. Mutat Res. 2004;567(1):1-61.
8. Ames BN, Shigenaga MK, Hagen TM. Oxidants, antioxidants, and the degenerative diseases of aging. Proc Natl Acad Sci USA. 1993;90(17):7915-22.
9. Rivière J, Ravanat JL, Wagner JR. Ascorbate and H
2O
2 induced oxidative DNA damage in Jurkat cells. Free Radic Biol Med. 2006;40(12):2071-9.
10. Duarte TL, Lunec J. When is an antioxidant not an antioxidant? A review of novel actions and reactions of vitamin C. Free Radic Res. 2005;39(7):671-86.
11. Circu ML, Aw TY. Reactive oxygen species, cellular redox systems, and apoptosis. Free Radic Biol Med. 2010;48(6):749-62.
12. Lenton KJ, Therriault H, Fülöp T, Payette H, Wagner JR. Glutathione and ascorbate are negatively correlated with oxidative DNA damage in human lymphocytes. Carcinogenesis. 1999;20(4):607-13.
13. Carr A, Frei B. Does vitamin C act as a pro-oxidant under physiological conditions? FASEB J. 1999;13(9):1007-25.
14. Moller P, Loft S. Interventions with antioxidants and nutrients in relation to oxidative DNA damage and repair. Mutat Res. 2004;551(1-2):79-81.
15. Podmore DI, Griffiths HR, Herbert KE, Mistry N, Mistry P, Lunec J. Vitamin C exhibits pro-oxidant properties. Nature. 1998;392(6676):559.
16. Poulsen HE, Weimann A, Salonen JT, Nyyssönen K, Loft S, Cadet J, et al. Does vitamin C have a pro-oxidant effect? Nature. 1998;395(6699):231-2.
17. Moller P, Viscovich M, Lykkesfeldt J, Loft S, Jensen A, Poulsen HE. Vitamin C supplementation decreases oxidative DNA damage in mononuclear blood cells of smokers. Eur J Nutr. 2004;43(5):267-75.
18. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983;65(1-2):55-63.
19. Zdanov S, Remacle J, Toussaint O. Establishment of H
2O
2-induced premature senescence in human fibroblasts concomitant with increased cellular production of H
2O
2. Ann N Y Acad Sci. 2006;1067:210-6.
20. Nicoletti I, Migliorati G, Pagliacci MC, Grignani F, Riccardi C. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods. 1991;139(2):271-9.
21 Vermes I, Haanen C, Steffens-Nakken H, Reutelingsperger C. A novel assay for apoptosis. Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V. J Immunol Methods. 1995;184(1):39-51.
22. Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Oxidative stress and cell signalling. Curr Med Chem. 2004;11(9):1163-82.
23. Stadtman ER. Role of oxidant species in aging. Curr Med Chem. 2004;11(9):1105-12.
24. Valko M, Rhodes CJ, Moncol J, Izacovic M, Mazur M. Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chem Biol Interact. 2006;160(1):1-40.
25. Darr D, Combs S, Pinnell S. Ascorbic acid and collagen synthesis: rethinking a role for lipid peroxidation. Arch Biochem Biophys. 1993;307(2):331-5.
26. Frei B, Stocker R, Ames BN. Antioxidant defenses and lipid peroxidation in human blood plasma. Proc Natl Acad Sci USA. 1988;85(24):9748-52.
27. Halliwell B. Vitamin C and genomic stability. Mutat Res. 2001;475(1-2):29-35.
28. Duarte TL, Almeida GM, Jones GD. Investigation of the role of extracellular H
2O
2 and transition metal ions in the genotoxic action of ascorbic acid in cell culture models. Toxicol Lett. 2007;170(1):57-65.
29. Ponec M, Weerheim A, Kempenaar J, Mulder A, Gooris GS, Bouwstra J, et al. The formation of competent barrier lipids in reconstructed human epidermis requires the presence of vitamin C. J Invest Dermatol. 1997;109(3):348-55.
30. Smith AR, Visioli F, Hagen TM. Vitamin C matters: increased oxidative stress in cultured human aortic endothelial cells without supplemental ascorbic acid. FASEB J. 2002;16(9):1102-4.
31. Singh NP. Sodium ascorbate induces DNA single-strand breaks in human cells in vitro. Mutat Res. 1997;375(2):195-203.
32. Henle ES, Linn S. Formation, prevention, and repair of DNA damage by iron/hydrogen peroxide. J Biol Chem. 1997;272(31):19095-98.
33. Rodrigo R, Guichard C, Charles R. Clinical pharmacology and therapeutic use of antioxidant vitamins. Fundam Clin Pharmacol. 2007;21(2):111-27.
34. Dimri GP, Lee X, Basile G, Acosta M, Scott G, Roskelley C, et al. A Biomarker that identifies senescent human cells in culture and aging skin in vivo. Proc Natl Acad Sci U S A. 1995;92(20):9363-7.
35. Frippiat C, Chen QM, Zdanov S, Magalhaes JP, Remacle J, Toussaint O. Subcytotoxic H
2O
2 stress triggers a release of transforming growth factor-beta 1, which induces biomarkers of cellular senescence of human diploid fibroblasts. J Biol Chem. 2001;276(4):2531-7.
36. Frippiat C, Dewelle J, Remacle J, Toussaint O. Signal transduction in H
2O
2-induced senescence-like phenotype in human diploid fibroblasts. Free Radic Biol Med. 2002;33(10):1334-46.
37. Severino J, Allen RG, Balin S, Balin A, Cristofalo VJ. Is beta-galactosidase staining a marker of senescence in vitro and in vivo? Exp Cell Res. 2000;257(1):162-71.
38. Frippiat C, Chen QM, Remacle J, Toussaint O. Cell cycle regulation in H
2O
2-induced premature senescence of human diploid fibroblasts and regulatory control exerted by the papilloma virus E6 and E7 proteins. Exp Gerontol. 2000;35(6-7):733-45.
39. Dumont P, Burton M, Chen QM, Gonos ES, Frippiat C, Mazarati JB, et al. Induction of replicative senescence biomarkers by sublethal oxidative stresses in normal human fibroblast. Free Radic Biol Med. 2000;28(3):361-73.
40. Duarte TL, Jones GD. Vitamin C modulation of H
2O
2-induced damage and iron homeostasis in human cells. Free Radic Biol Med. 2007;43(8):1165-75.
41. Martindale JL, Holbrook NJ. Cellular response to oxidative stress: signaling for suicide and survival. J Cell Physiol. 2002;192(1):1-15.
42. Sané AT, Cantin AM, Paquette B, Wagner JR. Ascorbate modulation of H
2O
2 and camptothecin-induced cell death in Jurkat cells. Cancer Chemother Pharmacol. 2004;54(4):315-21.
43. Chen Q, Espey MG, Krishna MC, Mitchell JB, Corpe CP, Buettner GR, et al. Pharmacologic ascorbic acid concentrations selectively kill cancer cells: action as a pro-drug to deliver hydrogen peroxide to tissues. Proc Natl Acad Sci USA. 2005;102(38):13604-9.
1. MD. Mestre em Ciências pelo Programa de Pós-Graduaçao em Cirurgia Plástica pela Universidade Federal de Sao Paulo, Sao Paulo, SP, Brasil.
2. MD, PhD. Professor Adjunto da Disciplina de Cirurgia Plástica da Escola Paulista de Medicina/ Universidade Federal de Sao Paulo, Sao Paulo, SP, Brasil.
3. MD, PhD, Professora Titular da Disciplina de Cirurgia Plástica da Escola Paulista de Medicina/ Universidade Federal de Sao Paulo, Sao Paulo, SP, Brasil.
Correspondência:
Prof. Alfredo Gragnani
Rua Napoleao de Barros, 715 - 4º andar - Vila Clementino
Sao Paulo,SP, Brasil - CEP 04024-002
E-mail: alfredogf@ig.com.br
Artigo recebido: 6/11/2011
Artigo aceito: 24/2/2012
Trabalho realizado no Laboratório de Cultivo de Células da Disciplina Cirurgia Plástica da Universidade Federal de Sao Paulo, Sao Paulo, SP, Brasil.